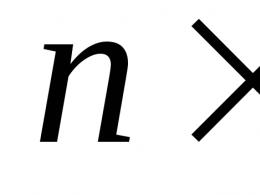З формули масової частки елемента. Як розрахувати масову частку речовини. Масова частка елемента у молекулі
Масова частка - один із важливих параметрів, який активно використовується для розрахунків і не лише у хімії. Приготування сиропів та розсолів, розрахунок внесення добрив на площу під ту чи іншу культуру, приготування та призначення лікарських препаратів. Для цих розрахунків потрібна масова частка. Формула для її знаходження буде дана нижче.
У хімії вона розраховується:
- для компоненту суміші, розчину;
- для складової частини сполуки (хімічного елемента);
- для домішок до чистих речовин.
Розчин - це теж суміш, лише гомогенная.
Масова частка- це відношення маси компонента суміші (речовини) до всієї його маси. Виражають у звичайних числах або у відсотках.
Формула для знаходження така:
? = (m (сост. частини) · m (суміші, в-ва)) / 100%.
Знаходження масової частки хімічного елемента
Масова частка хімічного елементау речовині знаходиться по відношенню атомної маси хімічного елемента, помноженої на кількість його атомів у цій сполукі, молекулярної маси речовини.
Наприклад, для визначення wкисню (оксигену) у молекулі Вуглекислий газСО2 спочатку знайдемо молекулярну масу всього з'єднання. Вона становить 44. У молекулі міститься 2 атоми кисню. Значить wкисню розраховуємо так:
w(O) = (Ar(O) · 2) / Mr(СО2)) х 100%,
w(O) = ((16 · 2) / 44) х 100% = 72,73%.
Аналогічним чином у хімії визначають, наприклад, wводи в кристалогідраті - комплексі з'єднання з водою. У такому вигляді у природізнаходяться багато речовин у мінералах.
Наприклад, формула мідного купоросу CuSO4 · 5H2O. Щоб визначити wводи в цьому кристалогідраті, потрібно у вже відому формулу підставити, відповідно, Mrводи (у чисельник) та загальну mкристалогідрату (у знаменник). Mrводи 18, а всього кристалогідрату - 250.
w(H2O) = ((18 · 5) / 250) · 100% = 36%
Знаходження масової частки речовини у сумішах та розчинах
Масова частка хімічної сполуки в суміші або розчині визначається за тією ж формулою, тільки в чисельнику буде маса речовини в розчині (суміші), а в знаменнику - маса всього розчину (суміші):
? = (m (в-ва) · m (р-ра)) / 100%.
Слід звернути увагу, що масова концентрація - це відношення маси речовини до маси всього розчину, а не лише розчинника.
Наприклад, розчинили 10 г кухонної соліу 200 г води. Потрібно знайти відсоткову концентрацію солі в отриманому розчині.
Для визначення концентрації солі нам потрібна mрозчину. Вона складає:
m (р-ра) = m (солі) + m (води) = 10 + 200 = 210 (г).
Знаходимо масову частку солі в розчині:
? = (10 · 210) / 100% = 4,76%
Таким чином, концентрація кухонної солі у розчині складе 4,76%.
Якщо за умови завдання дається не m, а об'єм розчину, його потрібно перевести в масу. Робиться це зазвичай через формулу для знаходження густини:
де m – маса речовини (розчину, суміші), а V – його обсяг.
Таку концентрацію використовують найчастіше. Саме її мають на увазі (якщо немає окремих вказівок), коли пишуть про відсотковий вміст речовин у розчинах та сумішах.

У завданнях часто дається концентрація домішок у речовині чи речовини у його мінералах. Слід звернути увагу, що концентрація (масова частка) чистого з'єднання визначатиметься шляхом віднімання з 100% частки домішки.
Наприклад, якщо йдеться, що з мінералу одержують залізо, а відсоток домішок 80%, то чистого заліза в мінералі 100 – 80 = 20%.
Відповідно, якщо написано, що в мінералі міститься лише 20% заліза, то у всі хімічні реакції та у хімічному виробництві братимуть участь саме ці 20%.
Наприкладдля реакції з соляною кислотою взяли 200 г природного мінералу, в якому вміст цинку 5%. Для визначення маси взятого цинку користуємося тією самою формулою:
? = (m (в-ва) · m (р-ра)) / 100%,
з якої знаходимо невідому mрозчину:
m (Zn) = (w · 100%) / m (мін.)
m (Zn) = (5 · 100) / 200 = 10 (г)
Тобто, 200 г взятого для реакції мінералу міститься 5% цинку.
Завдання. Зразок мідної руди масою 150 г містить сульфід міді одновалентної та домішки, масова частка яких становить 15%. Обчисліть масу сульфіду міді у зразку.
Рішення Завдання можливе двома способами. Перший - це знайти за відомою концентрації масу домішок і відняти її від загальної mзразок руди. Другий спосіб – це знайти масову частку чистого сульфіду і за нею вже розрахувати його масу. Вирішимо обома способами.
- I спосіб
Спочатку знайдемо mдомішок у зразку руди. Для цього скористаємося вже відомою формулою:
? = (m (домішок) · m (зразка)) / 100%
m(примес.) = (w · m (зразка)) · 100% , (А)
m(примес.) = (15 · 150)/100% = 22,5 (г).
Тепер по різниці знайдемо кількість сульфіду у зразку:
150 – 22,5 = 127,5 г
- II спосіб
Спочатку знаходимо wз'єднання:
А тепер по ній, скориставшись тією самою формулою, що й у першому способі (формула А), знайдемо mсульфіду міді:
m(Cu2S) = (w · m (зразка)) / 100%
m(Cu2S) = (85 · 150)/100% = 127,5 (г).
Відповідь: маса сульфіду міді одновалентного у зразку становить 127,5 г.
Відео
З відео ви дізнаєтесь, як правильно робити розрахунки за хімічними формулами та як знайти масову частку.
Знаючи хімічну формулу, можна визначити масову частку хімічних елементів у речовині. елемента в речовині позначається грец. літерою «омега» - Е/В і розраховується за формулою:
де k - Число атомів цього елемента в молекулі.
Яка масова частка водню та кисню у воді (Н2О)?
Рішення:
M r (Н 2 О) = 2 * А r (Н) + 1 * А r (О) = 2 * 1 + 1 * 16 = 18
2) Обчислюємо масову частку водню у воді:
3) Обчислюємо масову частку кисню у питній воді. Оскільки до складу води входять атоми лише двох хімічних елементів, масова частка кисню дорівнюватиме:

Рис. 1. Оформлення розв'язання задачі
Розрахуйте масову частку елементів у речовині H 3 PO 4 .
1) Обчислюємо відносну молекулярну масу речовини:
M r (Н 3 РО 4) = 3 * А r (Н) + 1 * А r (Р) + 4 * А r (О) = 3 * 1 + 1 * 31 +4 * 16 = 98
2) Обчислюємо масову частку водню у речовині:
3) Обчислюємо масову частку фосфору в речовині:
4) Обчислюємо масову частку кисню у речовині:
1. Збірник завдань та вправ з хімії: 8-й клас: до підручника П.А. Оржековського та ін. «Хімія, 8 клас»/П.А. Оржековський, Н.А. Тітов, Ф.Ф. Гегеля. - М: АСТ: Астрель, 2006.
2. Ушакова О.В. Робочий зошит з хімії: 8 кл.: до підручника П.А. Оржековського та ін. «Хімія. 8 клас»/О.В. Ушакова, П.І. Беспалов, П.А. Оржековський; під. ред. проф. П.А. Оржековського - М: АСТ: Астрель: Профіздат, 2006. (с.34-36)
3. Хімія: 8-й клас: навч. для загальнообр. установ/П.А. Оржековський, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (§ 15)
4. Енциклопедія для дітей. Том 17. Хімія/Голов. ред.В.А. Володін, вед. наук. ред. І. Леєнсон. - М: Аванта +, 2003.
1. Єдина колекція цифрових освітніх ресурсів ().
2. Електронна версія журналу «Хімія життя» ().
4. Відеоурок на тему «Масова частка хімічного елемента в речовині» ().
Домашнє завдання
1. с.78 № 2з підручника «Хімія: 8-й клас» (П.А. Оржековський, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005).
2. с. 34-36 №№ 3,5з Робочого зошита з хімії: 8 кл.: до підручника П.А. Оржековського та ін. «Хімія. 8 клас»/О.В. Ушакова, П.І. Беспалов, П.А. Оржековський; під. ред. проф. П.А. Оржековського – М.: АСТ: Астрель: Профіздат, 2006.
На даний момент відомо близько 120 різних хімічних елементів, з яких у природі можна виявити не більше 90. Різноманіття різних хімічних речовин навколо нас незрівнянно більше цього числа.
Пов'язано це про те, що дуже рідко хімічні речовини складаються з окремих, які пов'язані між собою атомів хімічних елементів. Такою будовою в звичайних умовах має лише невеликий ряд газів, які називають благородними — гелій, неон, аргон, криптон, ксенон і радон. Найчастіше, хімічні речовини складаються не з розрізнених атомів, та якщо з їх об'єднань у різні угруповання.
Тобто, атоми більшості хімічних елементів здатні зв'язуватися один з одним. Найчастіше внаслідок цього виходять молекули – частки, які є угруповання із двох чи більше атомів. Наприклад, хімічна речовина водень складається з молекул водню, які утворюються з атомів таким чином:
Малюнок 3. Утворення молекули водню
Утворювати зв'язки один з одним можуть і атоми різних хімічних елементів, наприклад, при взаємодії атома кисню з двома атомами водню утворюється молекула води:

Малюнок 4. Утворення молекули води
Оскільки щоразу малювати атоми хімічних елементів і підписувати їх незручно, відображення складу молекул були придумані хімічні формули. Так, наприклад, формула молекулярного водню записується як Н 2 де число 2, написане підрядковим шрифтом праворуч від символу атома водню, означає кількість атомів даного типу в молекулі. Таким чином, формулу води можна записати як H2O. Одиниця, яка повинна показувати кількість атомів кисню в молекулі, згідно з прийнятими в хімії правилами, не пишеться. Числа, що позначають кількість атомів у складі однієї молекули називають індексами.
Розглянемо ще кілька прикладів хімічних формул. Так, формула аміаку записується як NH 3 що говорить про те, що кожна молекула аміаку складається з одного атома азоту і трьох атомів водню.
Нерідко зустрічаються молекули, у яких можна нарахувати кілька однакових груп атомів. Наприклад, з формули сульфату алюмінію Al 2 (SO 4) 3 можна зробити висновок про те, що в складі молекули даної речовинизнаходяться дві групи атомів SO4.
Таким чином, хімічні формули речовин однозначно характеризують як їхній якісний, так і кількісний склад.
З усього вищесказаного логічно випливає закон сталості складу речовини, встановлений ще 1808 року французьким ученим Жозефом Луї Прустом, і звучить він так:
Будь-яка чиста хімічна речовина має постійний якісний і кількісний склад, що не залежить від способу одержання цієї речовини.
Оскільки будь-яка хімічна речовина є сукупністю молекул однакового складу, це призводить до того, що пропорції між атомами хімічних елементів будь-якої порції речовини такі ж, як і в одній молекулі даної речовини. Всі відмінності в хімічних властивостях речовин залежать від кількісного та якісного складу молекул і, крім того, від порядку зв'язків атомів між собою, якщо таке можливе.
Таким чином, можна дати таке визначення терміну молекула:
Молекула – це найменша частка будь-якого хімічної речовинищо володіє його хімічними властивостями.
Аналогічно відносної атомної маси існує також і таке поняття як відносна молекулярна маса M r:
Відносна молекулярна маса (M r) речовини - це відношення маси однієї молекули цієї речовини до однієї дванадцятої маси одного атома вуглецю (1 атомної одиниці маси).
Таким чином, очевидно, що відносна молекулярна маса складається з відносних атомних мас елементів, кожна з яких помножена кількість атомів даного конкретного типу в одній молекулі. Так, наприклад, відносна молекулярна маса молекули азотної кислоти HNO 3 складається з відносної атомної маси водню, відносної атомної маси азоту та трьох відносних атомних мас кисню:
Для опису якісного та кількісного складу речовини використовують таке поняття як масова частка хімічного елемента w(X).
Масовою часткоюназивають відношення маси цього компонента m(X) до маси всього розчину М(р-ра). Масову частку позначають символом ω (омега) і виражають у частках одиниці або у відсотках:
ω(Х) = m(Х)/М(р-ра) (у частках одиниці);
ω(Х) = m(Х) 100/М(р-ра) (у відсотках).
Молярною концентрацією називають кількість розчиненої речовини на 1 л розчину. Її позначають символом з (Х) і вимірюють моль/л:
с(Х) = n(X)/V = m(X)/M(X) V.
У цій формулі n(Х) – кількість речовини Х, що міститься у розчині, M(X) – молярна маса речовини Х.

Розглянемо кілька типових завдань.
- Визначити масу броміду натрію, що міститься в 300 г 15% розчину.
Рішення.
Масу броміду натрію визначимо за формулою: m(NaBr) = М(р-ра)/100;
m(NaBr) = 15300/100 = 45 р.
Відповідь: 45 р.
2. Маса нітрату калію, яку потрібно розчинити в 200 г води для отримання 8%-ного розчину, дорівнює ______ р. (Відповідь округліть до цілого числа.)
Рішення.
Нехай m(KNO 3) = х г, тоді М(р-ра) = (200 + х) р.
Масова частка нітрату калію в розчині:
ω(KNO 3) = x/(200 + x) = 0,08;
х = 16 + 0,08 х;
0,92 х = 16;
х = 17,4.
Після заокруглення х = 17 р.
Відповідь: 17 р.
3. Маса хлориду кальцію, яку потрібно додати до 400 г 5%-ного розчину цієї солі, щоб подвоїти її масову частку, дорівнює______ р. (Відповідь запишіть з точністю до десятих.)
Рішення.
Маса CaCl 2 у вихідному розчині дорівнює:
m(CaCl 2) = М (р-ра);
m(CaCl 2) = 0,05 400 = 20 г.
Масова частка CaCl 2 у кінцевому розчині дорівнює ω 1 = 0,05 2 = 0,1.
Нехай маса CaCl 2 яку потрібно додати у вихідний розчин, дорівнює х р.
Тоді маса кінцевого розчину М 1 (Р-ра) = (400 + х) р.
Масова частка CaCl 2 у кінцевому розчині:
Розв'язавши це рівняння, отримаємо х = 22,2 г.
Відповідь: 22,2 р.
4. Маса спирту, яку потрібно випарувати з 120 г 2%-ного спиртового розчину йоду, щоб підвищити його концентрацію до 5%, дорівнює _____________ (Відповідь запишіть з точністю до десятих.)
Рішення.
Визначимо масу йоду у вихідному розчині:
m(I 2) = М(р-ра);
m(I 2) = 0,02 120 = 2,4 г,
Після випарювання маса розчину стала рівна:
М 1 (р-ра) = m(I 2)/ω 1
М 1 (р-ра) = 2,4 / 0,05 = 48 р.
По різниці мас розчинів знаходимо масу спирту, що випарувався: 120-48 = 72 г.
Відповідь: 72 р.
5. Маса води, яку потрібно додати до 200 г 20%-ного розчину броміду натрію, щоб отримати 5%-ний розчин, дорівнює_________ р. (Відповідь округліть до цілого числа.)
Рішення.
Визначимо масу броміду натрію у вихідному розчині:
m(NaBr) = М(р-ра);
m(NaBr) = 0,2 200 = 40 г.
Нехай маса води, яку потрібно додати для розведення розчину, дорівнює x г, тоді за умовою завдання:
Звідси отримаємо х = 600 р.
Відповідь: 600 р.
6. Масова частка сульфату натрію в розчині, отриманому при змішуванні 200 г 5%-ного і 400 г 10%-ного розчинів Na 2 SO 4 дорівнює _____________ %. (Відповідь округліть до десятих.)
Рішення.
Визначимо масу сульфату натрію в першому вихідному розчині:
m 1 (Na 2 SO 4) = 0,05200 = 10 г.
Визначимо масу сульфату натрію у другому вихідному розчині:
m 2 (Na 2 SO 4) = 0,1400 = 40 г.
Визначимо масу натрію сульфату в кінцевому розчині: m(Na 2 SO 4) = 10 + 40 = 50 г.
Визначимо масу кінцевого розчину: М (р-ра) = 200 + 400 = 600 г.
Визначимо масову частку Na 2 SO 4 у кінцевому розчині: 50/600 = 8,3%
Відповідь: 8,3%.
На додаток до вирішення завдань на розчини:
"Правилом хреста" називають діагональну схему правила змішування для випадків із двома розчинами.
http://pandia.ru/text/78/476/images/image034_1.jpg" alt="" width="400" height="120">
Маса однієї частини: 300/50 = 6 р.
Тоді
m1 = 615 = 90 г, .
m2 = 635 = 210 р.
Потрібно змішати 90 г 60% розчину та 210 г 10% розчину.
Поняття "частки" напевно вам вже знайоме.
Наприклад, шматок кавуна, зображений малюнку, становить одну чверть від цілого кавуна, тобто його частка дорівнює 1/4 чи 25%.
Щоб краще зрозуміти, що таке масова частка, уявіть собі кілограм цукерок (1000г), який мама купила своїм трьом дітям. З цього кілограма наймолодшій дитині дісталася половина всіх цукерок (несправедливо звичайно!). Старшому – лише 200г, а середньому – 300г.
Значить масова частка цукерок у молодшої дитини становитиме половину, або 1/2 або 50%. У середньої дитини буде 30%, а у старшої – 20%. Слід наголосити, що масова частка може бути безрозмірною величиною (чверть, половина, третина, 1/5, 1/6 тощо), а може вимірюватися у відсотках (%). За розв'язання розрахункових завдань масову частку краще переводити на безрозмірну величину.
Масова частка речовини у розчині

Будь-який розчин складається з розчинника та розчиненої речовини. Вода – найпоширеніший неорганічний розчинник. Органічними розчинниками можуть бути спирт, ацетон, діетиловий ефір та ін. Якщо за умови завдання не вказано розчинник, розчин вважається водним.
Масова частка розчиненої речовини розраховується за такою формулою:
$\omega_\text(в-ва)=\dfrac(m_\text(в-ва))(m_\text(р-ра))(\cdot 100\%)$
Розглянемо приклади розв'язання задач.
Скільки грамів цукру та води потрібно взяти для приготування 150г 10%-ного розчину цукру?
Рішення
m(р-ра) = 150г
$ \ omega $ (цукор) = 10% = 0,1
m(цукор) =?
m(цукор) = $\omega\textrm((цукор)) \cdot m(p-pa) = 0,1 \cdot 150 \textrm(г) = 15 \textrm(г)$
m (води) = m (р-ра) - m (цукор) = 150г - 15г = 135г.
ВІДПОВІДЬ: потрібно взяти 15г цукру та 135г води.
Розчин об'ємом 350 мл. і густиною 1, 142 г/мл містить 28 г хлориду натрію. Знайти масову частку солі у розчині.
Рішення
V(р-ра) = 350 мл.
$ rho $ (р-ра) = 1,142 г / мл
$\omega(NaCl)$=?
m(р-ра) = V(р-ра) $\cdot \rho$(р-ра)=350 мл $\cdot$ 1,142 г/мл=400г
$\omega(NaCl)=\dfrac(m(NaCl))(m\textrm((р-ра)))=\dfrac(28\textrm(г)) (400\textrm(г)) = 0,07 $=7%
ВІДПОВІДЬ: масова частка хлориду натрію $\omega(NaCl)$=7%
Масова частка елемента в молекулі
Формула хімічної речовини, наприклад $H_2SO_4$, містить багато важливої інформації. Вона позначає або окрему молекулу речовини, що характеризується відносною атомною масою, або 1 моль речовини, що характеризується молярною масою. Формула показує якісний (складається з водню, сірки та кисню) та кількісний склад (складається з двох атомів водню, атома сірки та чотирьох атомів кисню). За хімічною формулою можна знайти масу молекули загалом (молекулярну масу), а також обчислити співвідношення мас елементів у молекулі: m(H) : m(S) : m(O) = 2: 32: 64 = 1: 16: 32. При обчисленні співвідношень мас елементів потрібно враховувати їхню атомну масу і кількість відповідних атомів: $m(H_2)=1*2=2$, $m(S)=32*1=32$, $m(O_4)=16*4 = 64 $
Принцип розрахунку масової частки елемента аналогічний принципу розрахунку масової частки речовини в розчині і знаходиться за такою формулою:
$\omega_\text(ел-та)=\dfrac(Ar_(\text(ел-та))\cdot n_(\textrm(атомів)))(m_\text(молекули))(\cdot 100\%) $
Знайти масову частку елементів у сірчаній кислоті.
Рішення
Спосіб 1 (пропорція):
Знайдемо молярну масу сірчаної кислоти:
$M(H_2SO_4) = 1\cdot 2 + 32 + 16 \cdot 4=98\hspace(2pt)\textrm(г/моль)$
Одна молекула сірчаної кислоти містить один атом сірки, значить маса сірки в сірчаній кислоті становитиме: $m(S) = Ar(S) \cdot n(S) = 32\textrm(г/моль) \cdot 1$= 32г/моль
Приймемо масу всієї молекули за 100%, а масу сірки - за Х% і складемо пропорцію:
$M(H_2SO_4)$=98 г/моль - 100%
m(S) = 32г/моль - Х%
Звідки $X=\dfrac(32\textrm(г/моль) \cdot 100\%)(98\textrm(г/моль)) =32, 65\% =32\%$
Спосіб 2 (формула):
$\omega(S)=\dfrac(Ar_(\text(ел-та))\cdot n_(\textrm(атомів)))(m_\text(молекули))(\cdot 100\%)=\dfrac( Ar(S)\cdot 1)(M(H_2SO_4))(\cdot 100\%)=\dfrac(32\textrm(г/моль)\cdot 1)(98\textrm(г/моль))(\cdot 100%) \approx32, 7\%$
Аналогічно за формулою розрахуємо масові частки водню та кисню:
$\omega(H)=\dfrac(Ar(H)\cdot 2)(M(H_2SO_4))(\cdot 100\%)=\dfrac(1\textrm(г/моль)\cdot 2)(98\ textrm(г/моль))(\cdot 100\%)\approx2\%$
$\omega(O)=\dfrac(Ar(O)\cdot 4)(M(H_2SO_4))(\cdot 100\%)=\dfrac(16\textrm(г/моль)\cdot 4)(98\ textrm(г/моль))(\cdot 100\%)\approx65, 3\%$