Budova un RNK funkcijas. transporta RNS. Budova, funkcijas. tRNS molekulas shēma
Є proteīna molekulas sintēze no matricas RNS urāna (translācija). Tomēr, runājot par transkripciju, nukleotīdu secību nevar tieši pārvērst aminoskābē; Tāpēc tulkojuma tulkošanai ir nepieciešams starpnieks līdzīgā transporta RNS (tRNS), kuras funkcija ir ģenētiskā koda translācija uz aminoskābju “movu”.
Pārneses RNS globālais raksturojums
Transporta RNS vai tRNS ir mazas molekulas, kas piegādā aminoskābes uz olbaltumvielu sintēzes vietu (ribosomas). Šāda veida ribonukleīnskābes skaits klitinijā ir aptuveni 10% no kopējā RNS kopuma.
Tāpat kā citas šķirnes, tRNS veidojas no ribonukleozīda trifosfāta lāpstiņas. Nukleotīdu secības garums ir 70–90 joslas, un aptuveni 10% molekulārās struktūras satur nelielas sastāvdaļas.
Caur tām, kurām ādas aminoskābes veido savu nesēju kā tRNS, klitīns sintezē lielu skaitu dažādu molekulu. Papuve dzīva organisma formā, tās rādītājs svārstās no 80 līdz 100.
tRNS funkcijas
Transporta RNS ir galvenais proteīnu sintēzes substrāts, kas atrodas ribosomās. Saistību ar aminoskābēm un tRNS matricas secības unikalitātes dēļ sensora adaptera funkcija tiek transponēta proteīna formā. Šāda starpnieka mijiedarbība ar matricu, kas kodē, tāpat kā transkripcijā, balstās uz slāpekļa bāzu komplementaritātes principu.
tRNS galvas funkcija ir saistīta ar aminoskābju laternu pieņemšanu un to turpmāko transportēšanu uz proteīnu sintēzes aparātu. Aiz šī tehniskā procesa slēpjas lieliska bioloģiskā sajūta – ģenētiskā koda ieviešana. Šī procesa attīstība balstās uz aizskarošām iezīmēm:
- uxi aminoskābes kodē nukleotīdu tripleti;
- ādas tripletam (vai kodonam) ir antikodons, kas ienāk pirms tRNS noliktavas;
- dermālā tRNS var saistīties tikai ar dziedošu aminoskābi.

Tādā veidā proteīna aminoskābju secību nosaka fakts, ka tRNS šādā secībā būs komplementāra mijiedarbībai ar messenger RNS translācijas procesā. Iespējams, ka funkcionālo centru transporta RNS ir izpausmes pazīmes, no kurām viena ir saistīta ar aminoskābes pievienošanu, bet otra - saistīšanās ar kodonu. Tāpēc funkcijas ir cieši saistītas.
Budova transporta RNS
tRNS unikalitāte ir tāda, ka tās molekulārā struktūra nav lineāra. Vaughn ietver spirālveida dvolantsyugkovy līstes, kuras sauc par kātiem, un 3 odnolyantsyug cilpas. Aiz formas šāda uzbūve uzmin stabilo loksni.
tRNS struktūrai ir šādi stublāji:
- akceptētājs;
- antikodons;
- dihidrouridilovijs;
- pseidouridilijs;
- dodatkovy.
Underwine spirālveida kātiņus var noņemt no 5 līdz 7 Vatsona-Kriksona pāriem. Puves akceptora kātiņa galā ir neliela nepāra nukleotīdu 3-hidroksilgrupa, kas ir nepareiza aminoskābes molekula.

Strukturālais reģions mRNS saitei ir viena no tRNS cilpām. Ir iespējams atriebt antikodonu, kas ir komplementārs paša antikodona nozīmes tripletam un akceptējošajam galam, lai nodrošinātu tRNS adaptera funkciju.
Tretīna molekulas struktūra
"Stabilā loksne" ir tRNS sekundārā struktūra, proteo molekulas locīšanai iegūst L līdzīgu konformāciju, it kā tā būtu saistīta ar papildu ūdeņainām saitēm.
L-formai ir tRNS terciārā struktūra, un tā sastāv no divām gandrīz perpendikulārām A-RNS spirālēm, kas ir 7 nm garas un 2 nm garas. Šī molekulas forma ir mazāka par 2 cikliem, no kuriem viens satur antikodonu, bet otrs ir ar akceptora centru.

tRNS saistīšanās īpatnības ar aminoskābi
Aminoskābju aktivāciju (pievienošanu transporta RNS) veic aminoacil-tRNS sintetāze. Šis ferments vienlaikus veic 2 svarīgas funkcijas:
- katalizē kovalentās saites izveidi starp akceptora cilmes 3`-hidroksilgrupu un aminoskābi;
- nodrošināt dzīvotspējas izvēles principu.
Ādai tiem ir sava aminoacil-tRNS sintetāze. Tas var mijiedarboties tikai ar cita veida transporta molekulu. Tse nozīmē, ka atlikušais antikodons var būt komplementārs tripletam, kas kodē to pašu aminoskābi. Piemēram, leicīna sintetāze tiek inhibēta tikai attiecībā uz leicīna tRNS.
Aminoacil-tRNS sintetāzes molekulai ir trīs nukleotīdus saistošas zarnu konformācijas un lādiņi, kas ir komplementāri tRNS dubultā antikodona nukleotīdiem. Tādā veidā ferments apzīmē nepieciešamo transporta molekulu. Bagātināts ar atpazīšanas fragmentu ir akceptora stumbra nukleotīdu secība.
RNS- polimērs, monomēri, piemēram, ribonukleotīdi. Uz DNS virsmas RNS veido nevis divas, bet viena polinukleotīda lancete (vinyatok - deak RNS vīrusi var dubultot RNS). RNS nukleotīdi spēj izveidot ūdens saites savā starpā. RNS lances ir ievērojami īsākas nekā DNS lances.
RNS monomērs - nukleotīds (ribonukleotīds)- to veido trīs rehovīnu pārpalikumi: 1) slāpekļa bāze, 2) polikarbonāta monosaharīds (pentoze) un 3) fosforskābe. RNS slāpekļa bāzes tiek klasificētas arī kā pirimidīni un purīni.
RNS pirimidīna bāzes ir uracils, citozīns, purīna bāzes ir adenīns un guanīns. Monosaharīda RNS nukleotīdu attēlo riboze.
skat trīs veidu RNS: 1) informatīvs(matrica) RNS – iRNS (mRNS), 2) transports RNS — tRNS, 3) ribosoma RNS – rRNS.
Visu veidu RNS ar nesadalāmiem polinukleotīdiem var būt specifiska telpas konformācija un piedalīties proteīnu sintēzes procesos. Informācija par visu veidu RNS esamību tiek glabāta DNS. RNS sintēzes procesu uz DNS veidnes sauc par transkripciju.

Transporta RNS atlasiet 76 (no 75 līdz 95) nukleotīdus; molekulmasa - 25 000-30 000. Uz tRNS daļu nokrīt aptuveni 10% no kopējās RNS klitīnā. tRNS funkcijas: 1) aminoskābju transportēšana uz olbaltumvielu sintēzes vietu, ribosomas, 2) translācijas mediators. Klitīnās ir atrodami gandrīz 40 tRNS veidi, un to ādu var raksturot ar mazāku nukleotīdu secību. Tomēr visās tRNS ir intramolekulāru komplementāru šūnu šprotes, caur kurām tRNS veido konformācijas, kas uzmin stabilas lapas formu. Vai tRNS veido cilpu saskarei ar ribosomu (1), antikodona cilpu (2), cilpu kontaktam ar fermentu (3), akceptora stublāju (4), antikodonu (5). Aminoskābe savienojas līdz akceptora kāta 3" galam. Antikodons- Trīs nukleotīdi, kas "atpazīst" iRNS kodonu. No tā izriet, ka konkrēta tRNS var transportēt vienu aminoskābi, kas norāda uz antikodonu. Aminoskābes un tRNS pusītes specifika sasniedz enzīma aminoacil-tRNS sintetāzes jaudas robežu.
Ribosomu RNS slaucīt 3000-5000 nukleotīdus; molekulmasa - 1000000-1500000. Daļa rRNS veido 80-85% no kopējā RNS daudzuma klitīnā. Kompleksā ar ribosomu proteīniem rRNS satur ribosomas – organoīdus, kas inducē proteīnu sintēzi. Eikariotu šūnās rRNS sintēze notiek kodolos. rRNS funkcijas: 1) nepieciešamā ribosomas strukturālā sastāvdaļa, tādējādi nodrošinot ribosomas funkcionēšanu; 2) ribosomas un tRNS mijiedarbības nodrošināšana; 3) ribosomas un iRNS kodona-iniciatora vālītes saite un nolasīšanas rāmja apzīmējums; 4) ribosomas aktīvā centra formēšana.
Nukleīnskābes - augstas molekulārās runas, kas sastāv no mononukleotīdiem, piemēram, viens pret vienu saitēm polimēru lances 3",5"-fosfodiestera saišu palīdzībai, un iepakotas skavās dziesmu secībā.
Nukleīnskābes ir divu dažādu veidu biopolimēri: ribonukleīnskābe (RNS) un dezoksiribonukleīnskābe (DNS). Ādas biopolimērs sastāv no nukleotīdiem, kurus atšķir ogļhidrātu pārpalikums (riboze, dezoksiriboze) un viena no slāpekļa bāzēm (uracils, timīns). Vydpovidno to tsikh vіdminnosti nukleīnskābes i atņēma viņu vārdu.
Ribonukleīnskābes struktūra
RNS primārā struktūra
RNS molekulaє lineāri (tas ir, neatšifrēti) polinukleotīdi ar līdzīgu DNS organizācijas principu. RNS monomēri ir nukleotīdi, kas sastāv no fosforskābes, ogļhidrāta (ribozes) un slāpekļa bāzes, kas saistīti ar 3", 5"-fosfodiestera saitēm. RNS molekulas polinukleotīdu lāpstiņas ir polāras, tas ir. Var tikt traucēti 5' un 3" punkti. Tādējādi uz DNS virsmas RNS ir vienas joslas molekula. Šīs immanences iemesls ir trīs primārās struktūras pazīmes:- RNS uz DNS virsmas aizstāj dezoksiribozes ribozi, jo tai var būt papildu hidroksīda grupa. Hidroksigrupa, lai izjauktu mazākā kompakta dubulto struktūru
- Dažu sārņu jeb galveno slāpekļa bāzu (A, G, C un U) vidū timīns tiek aizstāts ar uraklu, kas tiek atdalīts no timīna bez metilgrupas klātbūtnes 5. pozīcijā. Rezultātā mainās hidrofobās mijiedarbības stiprums komplementārajā pārī A-U, kas arī samazina stabilu dubultmolekulu pieņemšanas efektivitāti.
- Nareshti, RNS (īpaši tRNS) ir augsts zm_st t. nelielas bāzes un nukleozīdi. Starp tiem ir dihidrouridīns (uracilā nav vienas apakšvarianta saites), pseidouridīns (arī uracils ir zemāks, saistīts ar ribozi), dimetiladenīns un dimetilguanīns (slāpekļa bāzēs divām papildu metilgrupām) un daudzi citi. Mayzhe visi tsі podstavi scho nepromozhnі pieņemt likteni papildu vzaєmodіyah. Tādējādi metilgrupas dimetiladenīnā (uz timīna un 5-metilcitozīna bāzes) atrodas pie tāda atoma, kas A-U pārī veido ūdens saites; otzhe, tagad tsey zv'yazyok zakryuchissya neiespējami. Turpinot dubultmolekulu transformāciju.
Tādā veidā plaši atzītajai RNS un DNS noliktavai var būt liela bioloģiska nozīme: pat ja RNS molekulas funkciju var veikt tikai vienas lancetes rāmī, kas ir visredzamāk attiecībā uz mRNS: ir svarīgi parādīt ka dubultlances molekula varētu būt caurspīdīga ar ribosomām.
Tajā pašā laikā, atsevišķos gadījumos lancetes RNS pārņemta ar dubultu struktūru, var izveidoties cilpas, izvirzījumi vai “matadatas” (1. att.). Tsya struktūru stabilizē bāzu apmaiņa pāros A::U un G:::C. Taču var izdarīt "nepareizas" likmes (piemēram, G U), un atsevišķās vietās "matasprādzes" un ugunī neparādās vienādi. Šādu cilpu noliktavā var samazināt līdz 50% no kopējā nukleotīdu skaita (īpaši tRNS un rRNS). Kopējais nukleotīdu skaits RNS svārstās no 75 vienībām līdz vairāk nekā tūkstotim. Alternatīvi atrodiet lielāko RNS par lielumu, kas ir īsāks uz hromosomu DNS.
MRNS primārā struktūra tika kopēta no DNS šūnām, lai iegūtu informāciju par polipeptīda lancetes primāro struktūru. Citu veidu RNS primārā struktūra (tRNS, rRNS, reta RNS) ir visizplatītāko DNS gēnu ģenētiskās programmas atlikuma kopija.
RNS sekundārā un terciārā struktūra
Ribonukleīnskābes (RNS) ir vienpavedienu molekulas, tāpēc atkarībā no DNS veida to sekundārās un terciārās struktūras ir neregulāras. Qi struktūras, kas parādās kā plaša polinukleotīdu lancetes konformācija, veidojas galvenokārt ar ūdeni saistītās un hidrofobās mijiedarbības dēļ starp slāpekļa bāzēm. Kamēr spirāle ir raksturīga dabiskajai DNS molekulai, RNS struktūra ir mainīga un labila. Rentgenstaru difrakcijas analīze parādīja, ka polinukleotīda RNS lancetes apvalki, noliecoties, vijas uz sevi ar izveidotajām iekšējām spirāles struktūrām. Struktūru stabilizācija sniedzas tālāk par lancetes antiparalēlo lantu slāpekļa bāzu komplementāro pāru rahunas; konkrēti pāri šeit є А-U, G-С і, vairāk, G-U. Šīs RNS molekulas izciļņi vinikayu kā īsi un gari bispirāli gabali, kas atrodas uz vienas lances; qі d_lyanki izklausās kā matadatas. RNS sekundārās struktūras modelis ar matadata veida elementiem tika izveidots 50. gadu beigās - uz 60. gadu vālītes. XX Art. A. S. Spirina (Krievija) un P. Doti (ASV) laboratorijās.
| Dejaki vidi RNS | ||
| Vidi RNS | Rozmirs nukleotīdos | Funkcija |
| gRNS – genoma RNS | 10000-100000 | |
| mRNS – informatīvā (veidnes) RNS | 100-100000 | pārsūta informāciju par proteīna struktūru no DNS molekulas |
| tRNS – transporta RNS | 70-90 | transportē aminoskābes uz olbaltumvielu sintēzes vietu |
| rRNS – ribosomu RNS | kilo diskrēto klašu no 100 līdz 500 000 | notikt ribosomās, piedaloties ribosomu struktūras sadalīšanā |
| sn-RNS - maza kodola RNS | 100 | noņem intronītu un fermentatīvi saista eksonītu no mRNS. |
| sno-RNS - maza kodola RNS | piedalīšanās tiešā vai veiktā bāzu modifikācijā rRNS un mazās kodola RNS, piemēram, metilēšanā un pseidouridinizācijā. Lielākā daļa mazo kodola RNS tiek aizstātas ar citu gēnu introniem | |
| srp-RNS - signāls, kas atpazīst RNS | atpazīst ekspresijai izmantoto proteīnu signālu secību un piedalās to pārnešanā caur citoplazmas membrānu | |
| mi-RNS - mikro-RNS | 22 | kontrolēt strukturālo gēnu translāciju, komplementāri saistoties ar netranslētu mRNS šūnu 3'-galiem |
Spirālveida struktūru izveidi pavada hipohromisks efekts - RNS daļiņu optiskā blīvuma izmaiņas pie 260 nm. Ruinuvannya tsikh struktūras vіdbuvaєtsya ar samazinātu RNS starpības jonu stiprumu vai pat sasilšanu līdz 60-70 °C; To sauc arī par kušanu, un to skaidro ar strukturālo pārejas spirāli - haotisku bumbiņu, ko pavada nukleīnskābes optiskā biezuma palielināšanās.
Klitīniem ir RNS veidi:
- informatīvā (vai šablona) RNS (iRNS vai mRNS) un її uz priekšu - heterogēna kodola RNS (rn-RNS)
- pārnes RNS (t-RNS) un її priekšējo
- ribosoma (r-RNS) un її priekšējā
- maza kodola RNS (sn-RNS)
- maza kodola RNS (sno-RNS)
- signāla atpazīšanas RNS (srp-RNS)
- miRNS (mi-RNS)
- Mitohondriju RNS (t + RNS).

Heterogēna kodola un informatīvā (matricas) RNS
Heterogēnā kodola RNS ir ekskluzīva eikariotiem. Tā ir ziņotāja RNS (i-RNS) priekšpuse, lai ģenētisko informāciju kodola DNS veidā pārnestu uz citoplazmu. Heterogēnu kodola RNS (premRNS) novērtēja Radian bioķīmiķis G. P. Georgievs. rn-RNS sugu skaits ir vienāds ar gēnu skaitu, lai kalpotu par genomu kodējošo secību tiešo kopiju, kuru dēļ DNS ir palindromu kopijas, kas ir sekundārā struktūra, lai atriebtos. matadatas un lineārie dilyanki. RNS transkripcijas procesā no DNS galvenā loma ir enzīmam RNS polimerāze II.
Informatīvā RNS nosēžas rn-RNS apstrādes (nobriešanas) rezultātā, kurā dzimst matadatas, ir redzamas diverģences (introns), kas nekodē, un kodējošie eksoni tiek salīmēti kopā.
Informatīvā RNS (i-RNS) ir DNS DNS kopija, kas pirms proteīna (ribosomas) sintēzes veic DNS ģenētiskās informācijas nesēja lomu un tieši piedalās tās molekulu locīšanas procesā.
Nobriedušai matricas RNS ir neliels skaits reģionu ar dažādām funkcionālām lomām (att.)
- uz 5"-gala ir tā sauktais "vāciņš" jeb vāciņš - viena chotiriox modificētu nukleotīdu diļanka. Šāda struktūra aizsargā mRNS 5"-galu no endonukleāzēm.
- aiz "govju bara" ide 5 "-netulkots reģions - desmitiem desmitiem nukleotīdu secība. Tas ir komplementārs ar vienu no trim r-RNS tā, ka tas nonāk mazajā ribosomas apakšvienībā. bet tas nepārraida sevi.
- sākotnējais kodons - AUG, kas kodē metionīnu. Visām mRNS ir viens un tas pats sākuma kodons. MRNS tulkošana (lasīšana) sākas no jauna. Tā kā metionīns nav nepieciešams peptīdu lances sintēzei, vin, kā likums, tiek izmantots kā daļa no N-gala.
- Aiz iniciējošā kodona atrodas nākamā kodējošā daļa, kuras mērķis ir iegūt informāciju par aminoskābju secību proteīnā. Eikariotos nobriedušas mRNS ir monocistroniskas, tas ir. āda no tiem nesa informāciju par tikai viena polipeptīda lancetes struktūru.
Labajā pusē dažas peptīdu lāpstiņas retāk tiek novietotas uz ribosomām un sadalītas citu lāpstiņu šprotēs. Tātad to izmanto, piemēram, insulīna un veselas virknes oligopeptīdu hormonu sintēzē.
Eikariotu nobriedušās mRNS kodējošā daļa ir aiztaupīta introni - vai ir kādas iejauktās sekvences, kas nav kodētas. Citiem vārdiem sakot, nozīmes kodonu secībā nav pārtraukumu, jo tas ir jālasa tieši 5 " -> 3".
- Pēc secības secības pabeigšanas ir zināms termina kodons - viens no trim "klusajiem" kodoniem: UAA, UAG vai UGA (ģenētiskā koda sadalīšanas tabula zemāk).
- Cym kodonam var sekot 3'-netulkots reģions, kas ievērojami novirza 5'-netranslēto reģionu lejup pa straumi.
- Nareshti, var visas eikariotu mRNS (histona mRNS) 150–200 adenilnukleotīdu poli(A) fragmenta 3' galā.
3'-netranslācijas gēns un poli(A)-fragments var novest pie mRNS dzīves ilguma regulēšanas, mRNS traucējumu fragmentus kontrolē 3'-eksonukleāzes. Pēc mRNS translācijas pabeigšanas 10–15 nukleotīdi tiek sadalīti poli (A) fragmentā. Kad fragments ir novecojis, ievērojama mRNS daļa sāk sabrukt (piemēram, 3'-netulkota šūna).
Kopējais nukleotīdu skaits mRNS atšķiras tūkstošos. Kad tsimu par daļu, kas kodē, dažreiz mazāk nekā 60-70% nukleotīdu var nokrist.
Klitīnās mRNS molekulas var būt saistītas ar olbaltumvielām. Acīmredzot palieciet, stabilizējiet mRNS lineāro struktūru, lai tā apsteigtu gaismu tajā daļā, kas kodē "matadatu". Turklāt proteīni var nozagt mRNS no iepriekšējas recēšanas. Šādus mRNS kompleksus ar olbaltumvielām dažreiz sauc par informosomām.
Transporta RNS šūnas citoplazmā pārnes aminoskābes aktivētā veidā uz ribosomām, smakas tiek pievienotas peptīdu lāpstiņām dziesmu secībā, ko nosaka RNS šablons (mRNS). Šobrīd ir dati par nukleotīdu secību vairāk nekā 1700 tRNS sugām no prokariotu un eikariotu organismiem. Visas smakas var apvienot gan to primārajās struktūrās, gan polinukleotīda lancetes locīšanas metodē sekundārajā struktūrā aiz komplementārajām nukleotīdu mijām, kas nonāk pirms to struktūrām.

Transporta RNS savā noliktavā var saturēt ne vairāk kā 100 nukleotīdus, starp kuriem ir liels skaits nenozīmīgu vai modificētu nukleotīdu. Pirmā atšifrētās transporta RNS daļa bija bula alanīna RNS, kas redzama no rauga. Analīze parādīja, ka alanīna RNS sastāv no 77 nukleotīdiem, kas sajaukti stingri noteiktās sekvencēs; to noliktavā ir tā sauktie mazie nukleotīdi, ko attēlo netipiski nukleozīdi
Alaninova tRNS atriebj 9 neiedomājamas bāzes ar vienu vai abām dekilcom metilgrupām, kuras ar tām tiek savienotas ar enzīmu ceļu pēc fosfodiestera saišu izveidošanas starp nukleotīdiem. Tsі podstavi nezdatnі līdz tradicionālo pāru pieņemšanai; Tam var kalpot, šim nosacīto mikroshēmu nogulumu mantojuma molekulas molekulas molekulu pamatu pereshkati sparjuts, jaki ir sekundārā navona formāta RNS, Ribosomoy, fermenti, nenovecojušie . Nukleotīdu secība tRNS būtībā nozīmē, ka tā pati secība tiek novērota gēnos, kuros tiek sintezēta tRNS. Secību var ievadīt, pamatojoties uz Vatsona un Krika noteiktajiem apakšstaciju īpašas savienošanas noteikumiem. 1970. gadā rocibula sintezēja vienu divkāršu DNS molekulu ar dubultu 77 nukleotīdu secību, un izrādījās, ka tā varētu būt paraugs alanīna pārneses RNS inducēšanai. Tieši tā, pirmais gēna sintezēšanas gabals. |
tRNS transkripcija
T-RNS molekulu transkripcija ir līdzīga sekvencēm, kas kodē її DNS, piedaloties fermentam RNS polimerāzei III. Transkripcijas rezultātā tRNS primārā struktūra veidojas kā lineāra molekula. Veidošanās sākas no nukleotīdu secības locīšanas ar RNS polimerāzi līdzīgi kā gēns, lai noņemtu informāciju par doto pārneses RNS. Šī secība ir lineāra polinukleotīdu secība, kurā nukleotīdi iet pa vienam. Lineārā polinukleotīda lance ir primārā RNS, tRNS priekšpuse, kurā ietilpst introni - neinformatīvi lieki nukleotīdi. Šajā grupā pre-tRNS organizācija nav funkcionāla. Utvoryuyuchisya dažādās DNS hromosomu daļās pirms tRNS, lai aizstātu aptuveni 40 nukleotīdu pārpalikumu ar nobriedušu tRNS.
Vēl viens jaunizveidotās tRNS frontes posms ir pēctranskripcijas nogatavināšana vai apstrāde. Apstrādes gaitā tiek noņemtas neinformatīvās liekās pre-RNS un izveidotas pieaugušas, funkcionālas RNS molekulas.
pirms-tRNS apstrāde
Apstrādi ierosina fakts, ka transkriptā tiek izveidotas intramolekulāras ūdens saites un tRNS molekula ir veidota kā stabila lapa. Šī ir otrā tRNS organizācijas līnija, kurā tRNS molekula joprojām darbojas. Neinformatīvo šūnu tālāka attīstība no pre-RNS, "šķelto gēnu" informatīvo šūnu augšana - RNS 5 "- un 3" veida šūnu splicēšana un modificēšana.
Neinformatīvu pre-RNS šūnu attīstību atbalsta ribonukleāzes (eksotiskās endonukleāzes). Pēc lieko nukleotīdu atdalīšanas notiek tRNS bāzu metilēšana. Reakciju veic metiltransferāzes. S-adenozilmetionīns darbojas kā metilgrupu donors. tRNS iznīcināšanas metilēšanas maiņa ar nukleāzēm. Atlikuši nobriedušu tRNS nostāda, izmantojot īpašu nukleotīdu trīsvienības (akceptora gals) - CCA - ienākšanas ceļu, ko rada īpaša RNS polimerāze.
Pabeidzot apstrādi sekundārajā struktūrā, dažu tRNS ribām atkal tiek izveidotas papildu ūdens saites, lai pārietu uz trešo organizācijas līmeni un izskatītos pēc tā sauktās L formas. Šāda veida tRNS izskatās kā hialoplazma.
Budova tRNS
Transporta RNS struktūras pamatā ir nukleotīdu virve. Taču caur tām, kuras, vai tā būtu nukleotīdu lance, var būt pozitīvi un negatīvi lādētas daļas, vīni nevar būt šūnā rūcošā stāvoklī. Uzlādētās daļas, pievelkot viena pret vienu, viegli izveido ūdens savienojumus savā starpā, ievērojot komplementaritātes principu. Ūdens saites himēriski savij t-RNS virkni un sasien to šajā pozīcijā. Rezultātā t-RNS sekundārā struktūra var izskatīties kā "stabila lapa" (Zīm.), kas savā struktūrā atriebj 4 divkāju vīnogulājus. Liels skaits nelielu un modificētu nukleotīdu, kas atrodami tRNS lances un vēlīnā līdz komplementārai mijiedarbībai, veido 5 vienceliņu metienus.
Ieskaitot t-RNS sekundārā struktūra tiek noteikta pēc komplementāru nukleotīdu savienošanas pārī laternā četrās tRNS šūnās. tRNS šūnas, kas neizstaro, kamēr nav izveidotas ūdens saites starp nukleotīdiem, izveido cilpas vai lineāras saites. tRNS ir redzami šādi strukturālie sadalījumi:
- Dilyanka akceptors (kinets) kas sastāv no vairākiem lineāriem nukleotīdu izvērsumiem, no kuriem trīs var būt ar vienādu secību visu veidu tRNS – CCA. Adenozīnam pievieno hidroksilgrupu 3 "-ВІН. Aminoskābes karboksilgrupa ir pievienota jaunajai, un tRNS saimes nosaukums ir akceptors. Saistoties ar adenozīna 3"-hidroksilgrupu, aminoskābes tRNS ir tiek piegādāts ribosomu sintēzei.
- Antikodona cilpa skaņas utvoryuєtsya simoma nukleotīdi. Ir ādas tRNS specifisks nukleotīdu triplets, ko sauc par antikodonu. tRNS antikodons, ievērojot komplementaritātes principu, ir savienots pārī ar mRNS kodonu. Kodona un antikodona mijiedarbība nosaka aminoskābju izkliedes secību polipeptīda lancetē ribosomu locīšanas laikā.
- Pseidouridila cilpa (vai TΨC cilpa), kas sastāv no septiņiem nukleotīdiem un obov'yazykovo vengeance liekā pseidouridilskābes Ir atļauts, ka pseidouridila cilpa piedalās tRNS saistīšanā no ribosomas.
- Dihidrourīds jeb D-cilpa, kas sastāv no 8-12 nukleotīdu pārpalikumiem, starp kuriem ir daži dihidrouridīna pārpalikumi. Ir svarīgi atzīmēt, ka D-cilpa ir nepieciešama saistīšanai ar aminoacil-tRNS sintetāzi, jo tā piedalās savas tRNS atpazītajā aminoskābē (div. "Proteīna biosintēze"),
- Dodatkova cilpa, Yaka varіyyuє par razmirami un krājumu nukleotīdiem dažādās tRNS.
T-RNS tretīna struktūrai vairs nav stabilas lapas formas. Ūdens saišu nosēdināšanai starp nukleotīdiem no dažādām "arkusha staļļa" daļām, pīles saritinās uz molekulas korpusa un nosēžas šādā van der Vālsa papildu saišu pozīcijā, liekot domāt par burta G formu. vai L. Stabilas struktūras klātbūtne terciārai vēl vienai t-RNS iezīmei, kas liecina par diviem lineāriem m-RNS polinukleotīdiem. Lai saprastu, kā dažādās t-RNS sekundārās struktūras daļas ar izveidoto terciāro struktūru var redzēt attēlā, kurā parādīta t-RNS terciārās struktūras sekundārās struktūras krāsu shēma.


Transportēt RNS (t-RNS), lai proteīnu sintēzes laikā pārnestu aminoskābes no citoplazmas uz ribosomu. No tabulas ar ģenētisko kodu var redzēt, ka ādas aminoskābi kodē nukleotīdu decimāldaļas, tāpēc ādas aminoskābes dod savu transporta RNS. Rezultātā t-RNS daudzveidība ir liela: no vienas līdz sešām sugām ādai ar 20 aminoskābēm. Skatīt tRNS, kas saistās ar vienu un to pašu aminoskābi, sauc par izoakceptoriem (piemēram, alanīnu var pievienot tRNS, antikodonam, kas papildinās kodonus GCU, GCC, GCA, GCG). tRNS specifiku norāda augšējais indekss, piemēram: tRNS Ala.
Olbaltumvielu sintēzes procesam ar t-RNS galvas funkcionālajām daļām є: antikodons - nukleotīdu secība, kas atrodas uz antikodona cilpas, komplementāra ziņotāja RNS (i-RNS) kodonam un akceptora daļai - t-RNS gala antikodona garums, kuram pievienota aminoskābe. Bāzu secību antikodonā var tieši deponēt aminoskābes veidā, kas pievienota 3"-kintsa. ģenētiskās informācijas pārraides pamatā, nesot šādu t-RNS.
T-RNS proteīna sintēzes procesā antikodons atpazīst i-RNS ģenētiskā koda (kodona) trīs burtu secību, kas apzīmē vienu aminoskābi, kas pievienota tRNS otrajam galam. Tikai tad, ja antikodonam ir atšķirīga komplementaritāte ar pārneses RNS mRNS plāksni, to var tai pievienot un dot aminoskābi, ko pārnest uz proteīna lancetes veidni. T-RNS un i-RNS mijiedarbība ir atrodama ribosomā, jo tā ir arī aktīva translācijas dalībniece.
T-RNS atpazīšanu tās aminoskābē un t-RNS kodonā nosaka dziesmu secība:
- "Savu" aminoskābju saistība ar t-RNS ir atkarīga no papildu enzīma - specifiskas aminoacil-tRNS sintetāzes
Aminoacil-tRNS-sintetāžu lielā daudzveidība ir saistīta ar to tRNS skaitu, kuras ir aizstājušas ar aminoskābēm. Tos īsi sauc par ARSazi. Aminoacil-tRNS sintetāzes ir lielas molekulas (mol. masa 100 000 - 240 000), kas veido ceturtdaļas struktūru. Viņi īpaši zina par tRNS un aminoskābēm un katalizē tās blakus. Attiecībā uz PSO ATF ir process, kurā notiek ATF, no Karboxide Kinzili I Podnnannya aktivācijas vikoristovijas uz Gidroxilu (3 "-on) adenozīna akceptora Kintsya (TsCA) TRNA trīs ATF centriem: savienošana ar kovalentās saites, tRNS līdzīgu aminoskābju izveidošana un šādas saites hidrolīze dažādās neatbilstībās (piesaiste tRNS "not tієї" aminoskābēm).
ARSase var uzvaroši vibrēt, atpazīstot ādas aminoskābju tRNS diapazonu, tobto. aminoskābi ievada vadu lanka, un tai tiek nogādāta sava tRNS. Ļaujiet tRNS vienkāršas difūzijas ceļā nogādāt tai atnesto aminoskābi uz ribosomām, noārda proteīna locījumu no aminoskābēm, kas jāatrod dažādās aminoacil-tRNS.

Aminoskābju saistīšanās ar tRNS
tRNS un aminoskābju saistīšanās notiek šādā secībā (att.): aminoskābi un ATP molekulu pievieno aminoacil-tRNS sintetāzei. Lai iegūtu nelielu aminoskābju, ATP molekula vibrē enerģiju, sadalot divas fosfātu grupas. AMP (adenozīna monofosfāts), kas paliek, pievienojas aminoskābēm, gatavojoties pievienoties ar tRNS akceptora plāksni - akceptora matadatu. Pēc šīs sintetāzes pie sevis nonāk tā pati sporas tRNS aminoskābe. Šajā posmā tiek veikta atkārtota tRNS sintetāzes veida pārbaude. Dažādos tRNS veidos tas ir stipri piesaistīts sintetāzei, mainot tās struktūru, kas noved pie aminoskābju mērķēšanas procesa uzsākšanas - aminoskābju pievienošanas tRNS.
Aminoacilēšana ir saistīta ar procesu, kurā aminoskābei pievienotā AMP molekula tiek aizstāta ar tRNS molekulu. Pēc AMP aizstāšanas sintetāze tiek izsmelta, un tRNS tiek apgriezta pārējai aminoskābju konversijai.
Pievienotās aminoskābes tRNS veida atkārtota pārbaude
Sintetāzes modelis pievienoto aminoskābju tRNS tipa maiņai norāda uz divu aktīvo centru klātbūtni: sintētisko un koriģējošo. Sintētiskajā centrā tRNS tiek pievienota aminoskābei. tRNS akceptoršūna, ko notver sintetāze, saskaras ar sintētisko centru uz vālītes, kur atrodas aminoskābe, un to iegūst ar AMP. Šis tRNS akceptoršūnas kontakts rada nedabisku vigin pirms aminoskābju pievienošanas. Turklāt, kad aminoskābe tiek pievienota tRNS akceptoršūnai, šīs šūnas klātbūtne sintētiskajā centrā samazinās, tRNS tiek iztaisnota un pārvietota uz aminoskābi, kas tai tiek pievienota korekcijas centrā. Kad aminoskābes molekula ir sajaukta, tā tiek pievienota tRNS, bet tā tiek pievienota korekcijas centram, aminoskābe tiek atzīta par nepareizu un nonāk tRNS. Sintetāze ir gatava nākamajam ciklam. Kad aminoskābes molekula ir paplašināta, pievienota tRNS, tad korekcijas centrs tiek uzlādēts ar aminoskābi, tRNS tiek aktivizēts: tā ir gatava spēlēt lomu proteīna translācijā. Un sintetāze ir gatava uzņemt jaunas aminoskābes un tRNS un sākt otro ciklu.
Vidējais nesintētisko aminoskābju skaits ar sintetāzi rodas 1. pilē 50 tūkstoši, un ar tRNS tRNS tikai vienu reizi 100 tūkstošos dienu.
- Mijiedarbība starp mRNS kodonu un tRNS antikodonu notiek pēc komplementaritātes un antiparalēlisma principa
tRNS mijiedarbība ar mRNS kodonu saskaņā ar komplementaritātes un pretparalēlisma principu nozīmē: sajūtu kodons mRNS nolasa taisnā līnijā 5 "-> 3", tad tRNS antikodons ir vainīgs, ka nolasa taisni 3 "-> 5" . Ar šiem pirmajiem diviem pāriem kodons un antikodons ir stingri komplementāri, tāpēc A U un G C savienošana pārī nav iespējama. Pieļaujamās likmes nosaka pēc shēmas:
Iznāk trīs shēmas.
- tRNS molekula saistās tikai ar 1. tipa kodonu, kā trešais nukleotīds її antikodonā - C vai A
- tRNS parādās ar divu veidu kodoniem, tā ka antikodons beidzas ar Y vai R.
- I, nareshti, tRNS parādās ar trīs veidu kodoniem, tā ka antikodons beidzas ar I (inozīna nukleotīds); šāda situācija, zocrema, alanīna tRNS.
Savukārt Zvіdsi kliedz, ka 61 sajūtu kodona atpazīšanai principā nevis tas pats, bet mazāks dažādu tRNS skaits.
Ribosomu RNS

Ribosomu RNS ir pamats ribosomu apakšvienību veidošanai. Ribosomas nodrošina vietu mRNS un tRNS savstarpējai sasaldēšanai olbaltumvielu sintēzes procesā.
Ādas ribosoma sastāv no lielām un mazām apakšvienībām. Apakšvienības ietver lielu skaitu proteīnu un ribosomu RNS, kam nav nepieciešama tulkošana. Ribosomas, kā arī ribosomu RNS izceļas ar sedimentācijas koeficientu (sedimentāciju), ko mēra Svedberga vienībās (S). Tsey koeficients nogulsnēšanai atbilstoši apakšvienību sedimentācijas stabilitātei centrifugēšanas laikā bagātīgā ūdens vidē.
Eikariotu ādas ribosomas sedimentācijas koeficients ir vienāds ar 80S, un ir pieņemts apzīmēt 80S daļiņu. Vons iekļauts
- neliela apakšvienība (40S), lai kompensētu ribosomu RNS ar 18S rRNS sedimentācijas koeficientu un 30 dažādu proteīnu molekulām,
- liela apakšvienība (60S), kurā ietilpst 3 dažādas rRNS molekulas (viena gara un divas īsas - 5S, 5.8S un 28S), kā arī 45 proteīna molekulas.
Apakšvienība utvoryuyut "skelets" no ribosomas, āda daži no eksudātiem ar to proteīniem. Kopējās ribosomas sedimentācijas koeficients nemainās no divu apakšvienību koeficientu summas, kas ir saistīts ar molekulas telpas konfigurāciju.
Prokariotu un eikariotu ribosomu piesaiste ir aptuveni vienāda. Viņi smird ar mazāku molekulmasu. Baktēriju ribosomas sedimentācijas koeficients ir 70S, un tā ir apzīmēta kā 70S daļa, kas norāda uz mazāku sedimentāciju; atriebties
- mazā (30S) apakšvienība - 16S rRNS + proteīni
- liela apakšvienība (50S) - 23S rRNS + 5S rRNS + lielās apakšvienības proteīni (mazs)
Vidējo slāpekļa bāzu rRNS tas izklausās zemāk guanīna un citozīna vietā. Nelieli nukleozīdi arī tiek noķerti, bet ne tik bieži kā tRNS: aptuveni 1%. Ce, galvenokārt nukleozīdi, ribozes metilēšana. RRNS sekundārajā struktūrā ir daudz punduru šūnu un cilpu (mazu). Šādas RNS molekulas tiek izveidotas divos secīgos procesos - DNS transkripcijā un RNS nogatavināšanā (apstrādē).
rRNS transkripcija no DNS un rRNS apstrādes
PrerRNS nogulsnējas kodolā, kur atrodas rRNS transkripcija. RRNS transkripciju no DNS atbalsta divas komplementāras RNS polimerāzes. RNS polimerāze I pārraksta 5S, 5.8S un 28S vienā garā 45S transkriptā, kas pēc tam sadalās vajadzīgajās daļās. Tādā veidā tiek nodrošināts vienāds molekulu skaits. Cilvēkiem ādas haploīdais genoms satur aptuveni 250 kopijas DNS sekvences, kas kodē 45S transkriptu. Smaka ir sakārtota piecos klasterizētos tandēma atkārtojumos (tas ir, pa vienam pa pāriem) 13., 14., 15., 21. un 22. hromosomu īsajās daļās. Šīs šūnas ir kodola organizētāji, kā arī to transkripcija un tālāka apstrāde. no kodola 45S-transkripta.
Ne mazāk kā trīs 1. hromosomas kopas ar 2000 5S-pRNS gēna kopijām. Їx transkripcija notiek RNS polimerāzes III līmeņa klātbūtnē kodolā.
Apstrādes procesā tiek zaudēta vairāk nekā puse pre-rRNS, un rRNS nogatavojas. Daži rRNS nukleotīdi ir pakļauti modifikācijām, kas ir līdzīgas metilētajām bāzēm. Reakciju veic metiltransferāzes. S-adenozilmetionīns spēlē metālu grupu donora lomu. RRNS kodolā ir saistīti ar ribosomu proteīniem, kas atrodas šeit, citoplazmā, un veido mazas un lielas ribosomas apakšdaļas. Sugas rRNS tiek transportētas no kodola uz citoplazmu kompleksā ar olbaltumvielām, kas tās papildus pasargā no pārrāvuma un pārnešanas.
ribosomu centri
Ribosomas dabiski atrodas citās šūnas organellās. Citoplazmā smakas ir dzirdamas divos stāvokļos: nepraktiskā, ja ūdens apakšvienības ir lielas un mazas, viena vienā, un aktīvajā, olbaltumvielu sintēzes funkcija nav vienāda, ja apakšvienības ir viens ar vienu.
Kā translācijas uzsākšana norādīts ribosomu apakšvienību montāžas process vai aktīvo ribosomu locīšana. Šī atlase ir stingri noteikta, lai nodrošinātu bagātīgus ribosomu funkcionālos centrus. Visi centri atrodas uz virsmām, kur tie saskaras, abas ribosomas apakšvienības. Pirms tiem var redzēt:
- mRNS saistīšanas centrs (M-centrs). 18S rRNS šķelšanā, ko papildina 5-9 nukleotīdu stiepums 5'-netulkotajā mRNS fragmentā
- Peptidila centrs (P-centrs). Tulkošanas procesa sākumā tas ir saistīts ar aa-tRNS ierosināšanu. Eikariotos visu mRNS sākotnējais kodons vienmēr kodē metionīnu, kas ir viena no divām metionīna aa-tRNS, ko norāda zemākais indekss i: Met-tRNS i Met. Tulkošanas progresīvās stadijās peptidil-tRNS atrodas P-centrā, kas jau ir sintezēta peptīda lanciug daļa.
Var runāt arī par E-centru (kā "izeja" - izeja), kur pārvietojas tRNS, kurā ir iestrādāta saite ar peptidilu, pirms iziet no ribosomas. Tomēr centru var aplūkot kā noliktavu P-centru.
- Aminoskābju centrs (A-centrs) ir melnā aa-tRNS saistīšanās vieta.
- Peptidiltransferāzes centrs (PTF centrs) - katalizē peptidila pārnešanu no peptidil-tRNS noliktavas uz melno aa-tRNS, kas atrodas A centrā. Šajā gadījumā tiek izveidota vēl viena peptīdu saite, un peptīdus apvieno viena aminoskābe.
Tāpat kā aminoskābju centrā, tā arī peptidilcentrā, vidpoīdās tRNS (aa-tRNS vai peptidil-tRNS) antikodona cilpa ir acīmredzami paplašināta līdz M-centram - matricas RNS saistīšanās centram (saskarne ar mRNS) , un akceptors PTP centram.
Rozpodіl centri starp apakšvienībām
Centru sadalījums starp ribosomas apakšvienībām ir šāds:
- Maza apakšvienība. Ja 18S-rRNS nav iespējams atriebties, jo mRNS saistās ar vietu, tad centrs atrodas uz šīs apakšvienības. Turklāt ir galvenā A centra daļa un neliela daļa P centra.
- Lieliska apakšvienība. Pārējo P-i A-centru daļu frēzēšanas її saskares virsmā. P-centra gadījumā ir visa galvenā daļa, un A-centra gadījumā ir AA-tRNS akceptora cilpas saite ar aminoskābes radikāli (aminoacilu); parādās reshta w un vairāk aa-tRNS ar minimālu apakšvienību. Lielā apakšvienība atrodas arī PTF centrā.
Ribosomu iniciācija (ribosomu sagatavošana pirms olbaltumvielu sintēzes)
Olbaltumvielu sintēzi jeb translācijas gaitā iedala trīs fāzēs: iniciācija (vālītes), pagarināšanās (polipeptīda lāpstiņas nolaišana) un izbeigšana (pabeigšana). Iniciācijas fāzē sākas ribosomas sagatavošana darbam: nākamā apakšvienība. Baktēriju un eikariotu ribosomās apakšvienība un translācijas auss notiek atšķirīgi.
Tulkošanas sākums ir vissvarīgākais process. Jaunajā krēmā ribosomu apakšvienības, mRNS un tRNS uzņemas GTP un trīs iniciācijas olbaltumvielu faktoru (IF-1, IF-2 un IF-3) lomu, kas nav ribosomas noliktavas sastāvdaļas. Iniciācijas faktori atvieglo mRNS saistīšanos ar mazo apakšvienību un GTP. GTP rahunok hidrolīzei nodrošina enerģiju ribosomas zmikannya apakšvienību procesam.

- Iniciācija ir saistīta ar to, ka neliela apakšvienība (40S) ir saistīta ar iniciatora faktoru IF-3, kā rezultātā notiek pāreja uz lielas apakšvienības priekšējo savienojumu un iespēja pievienoties tai mRNS.
- Tālāk pie kompleksa "mazā apakšvienība (40S) + IF-3" ir pievienota mRNS (tā 5" netulkotā starplika).
- Tālāk kompleksam "mazā apakšvienība + IF-3 + mRNS" tiek pievienoti vēl divi iniciējošie faktori: IF-1 un IF-2, bet pārējie satur īpašu pārneses RNS, ko sauc par iniciējošu aa-tRNS. Kompleksā ietilpst arī GTF uz noliktavu.
Neliela apakšvienība, kas seko mRNS, apzīmē divus kodonus lasīšanai. Pirmajam IF-2 proteīnam ir pievienots iniciators aa-tRNS. Cits kodons aizver IF-1 proteīnu, kas to bloķē un neļauj tai sasniegt uzbrūkošo tRNS, kamēr ribosoma nav pārlocīta.
- Kopš iniciējošās aa-tRNS saites, tad Met-tRNS i Met komplementārai saistībai ar mRNS (sākotnējais kodons AUG) un ribosomas apakšvienības ievietošana savā vietā P-centrā. GTP hidrolizējas līdz IKP un neorganiskajam fosfātam, un enerģija, kas tiek novērota šīs makroerģiskās saites veidošanās laikā, rada termodinamisku stimulu procesam noritēt vajadzīgajā tiešā veidā. Tajā pašā laikā iniciējošie faktori atņem ribosomu.
Tādā veidā no dažām galvenajām sastāvdaļām veidojas sava veida "sviestmaize". Kad tas notiek, mRNS (AUG) iniciējošais kodons parādās ribosomu ribosomas P-centrā, un ar to ir saistīts aa-tRNS, kas iniciē. Peptidil-tRNS loma ir peptidil-tRNS loma, kad tiek izveidota pirmā peptīdu saite.

RNS transkripti, kas sintezēti ar RNS polimerāzes palīdzību, sāk atpazīt attālas enzīmu transformācijas, ko sauc par pēctranskripcijas apstrādi, un tikai neliela smaka iegūst funkcionālo aktivitāti. Nenobriedušas messenger RNS transkriptus sauc par heterogēno kodola RNS (hnRNS). Smaku veido vēl divu RNS molekulu summa, kas atriebj intronu un eksoniju. hnRNS nobriešana (apstrāde) eikariotos ietver posmu apkaisīšanu, no kuriem viens ietver intronu atdalīšanu - netulkotas ievietotās sekvences un eksonu saplūšanu. Process notiek tā, ka eksonijs iekļūst pa vienam, tā ka kodējošie mRNS fragmenti netiek fiziski atdalīti. Eksoni noteikti ir saistīti viens ar otru, lai palīdzētu molekulām, jo tos sauc par mazajām kodola RNS (snRNS). Šo īso kodola RNS, kas sastāv no aptuveni 100 nukleotīdiem, funkcija jau sen ir bijusi neskaidra. Її tālu, lai pēc tam konstatētu, kā tika parādīts, ka to nukleotīdu secība ir komplementāra ar sekvencēm ādas z intronu galos. Rezultātā bāzu savienošana pārī, kas atrodas snRNS un cilpveida introna galos, divu eksonu sekvences tiek pietuvinātas tā, ka kļūst iespējams atdalīt intronu, tos sadalot un fermentatīvi kodē (splicing) fragmentus. Tādā veidā snRNS molekulas spēlē timhazijas matricu lomu, kas atrodas tuvu vienam divu eksonu galā, lai splicēšana notiktu pareizajā vietā (att.).
HnRNS transformācija iRNS iet caur attālo intronu ceļu RNS proteīnu kodola kompleksā, ko sauc par splicesomu. Ādas savienojumam ir kodols, kas sastāv no trim maziem (zemas molekulmasas) kodola ribonukleoproteīniem jeb snurpiv. Ādas snurp, lai atriebtu vienu mazu kodola RNS un baltumu brētliņu. Ir simtiem dažādu mazu kodola RNS, kas tiek transkribētas galvenajā RNS polimerāzē II. Ir svarīgi atzīmēt, ka to galvenā funkcija ir specifisku ribonukleīna sekvenču atpazīšana papildu bāzu savienošanai pārī RNS-RNS tipam. HnRNS apstrādei vissvarīgākie ir Ul, U2, U4/U6 un U5.
Mitohondriju RNS
Mitohondriju DNS ir nepārtraukta cilpa un kodē 13 polipeptīdus, 22 tRNS un 2 rRNS (16S un 23S). Lielākā daļa gēnu atrodas uz vienas (svarīgas) lances, lances protea ir noslēpta un uz komplementārās plaušas. Šajā gadījumā lanceolāti tiek transkribēti šķietami nepārtrauktos transkriptos, lai palīdzētu mitohondrijiem specifiskai RNS polimerāzei. Šo fermentu kodē kodolgēns. Pēc tam visas RNS molekulas tiek sadalītas 37 sugās, un mRNS, rRNS un tRNS līdztulko 13 mRNS. Ir liels skaits piedevu proteīnu, kuriem no citoplazmas jāsasniedz mitohondriji un tie tiek tulkoti no kodolgēniem. Pacientiem ar sistēmiskiem tārpiem tiek noteiktas antivielas pret ķermeņa snurp-olbaltumvielām. Turklāt ir svarīgi atzīmēt, ka lielam gēnu kopumam hromosomas 15q mazajā kodola RNS ir svarīga loma Pradera-Villi sindroma patoģenēzē (oligofrēnijas samazināšanās, lēna augšana, aptaukošanās, m'yaziv hipotensija ).
Klitīna citoplazmā ir trīs galvenie RNS funkcionālie veidi:
- matricas RNS (mRNS), kas nosaka proteīnu sintēzes šablonu funkcijas;
- ribosomu RNS (rRNS), kas atspoguļo ribosomu strukturālo komponentu lomu;
- transporta RNS (tRNS), kas pārvērš (pārvērš) mRNS informāciju proteīna molekulas aminoskābju secībā.
Klitīnu kodolā tiek noteikta kodola RNS, kas svārstās no 4 līdz 10% no kopējās šūnu RNS. Kodola RNS galveno masu pārstāv ribosomu un pārneses RNS lielmolekulārie prekursori. Augstmolekulārie rRNS prekursori (28 S, 18 S un 5 S RNS) pārsvarā ir lokalizēti kodolā.
RNS e galvenais ģenētiskais materiāls dažos vīrusos, dzīvniekos un roslīnā (genomiskā RNS). Lielākajai daļai RNS vīrusu ir raksturīga to RNS genoma reversā transkripcija, ko vada reversā transkriptāze.
Visas ribonukleīnskābes ribonukleotīdu polimēri, savienots, tāpat kā DNS molekulā, ar 3",5"-fosforodiestera saitēm. Par DNS tipu, kam ir dubultā struktūra, RNS vienas joslas lineārās polimēru molekulas.
Budova mRNS. mRNS ir neviendabīgākā RNS klase stabilitātes un stabilitātes ziņā. MRNS daudzums klitīnās kļūst par 2-6% no kopējās RNS. mRNS veido šūnas – cistroni, kas nosaka aminoskābju secību olbaltumvielās, kuras tās kodē.
Budova tRNS . Transporta RNS nosaka mediatoru (adapteru) funkcijas mRNS translācijas stundā. Šajā proporcijā ietilpst aptuveni 15% no kopējās šūnu RNS. 20 proteīnogēno aminoskābju ādai ir sava tRNS. Aktīvām aminoskābēm, kuras kodē divi vai vairāki kodoni, izmanto tRNS savienojumu. tRNS ir salīdzinoši mazas vienas lancetes molekulas, kas sastāv no 70-93 nukleotīdiem. Molekulmasa kļūst (2,4-3,1) ,104 kDa.
tRNS sekundārā struktūra veidojas rahunokam ar maksimālo ūdens saišu skaitu starp iekšējiem molekulāriem komplementāriem slāpekļa bāzu pāriem. Šo saišu izveidošanas rezultātā tRNS polinukleotīdu lancete savijas ap izveidotajām spirālēm, kas beidzas ar nepāra nukleotīdu cilpām. Usіh tRNS formas sekundāro struktūru attēlu plašums. stabila lapa.
Pie "stabila palaga" tie atdalās chotiri obov'yazkovі hilki, vairāk dovgі tRNS, turklāt atriebība īss p'yat (papildu) gіlku. tRNS adaptera funkciju nodrošina akceptora uzmava, līdz 3"-punktam, kas pievienota ētera saitei ar aminoskābju pārpalikumu, un akceptora uzmavai pretī atrodas antikodona uzmava, kuras augšpusē atrodas cilpa, kas atriebj antikodona kodu
T-gylka, kas nes pseidouridīna cilpu (TyC-cilpu), nodrošina tRNS mijiedarbību ar ribosomām.
D-gylka, kas nesa dehidrouridīna cilpu, nodrošina tRNS mijiedarbību ar dzīvotspējīgo aminoacil-tRNS sintetāzi.
tRNS sekundārā struktūra
Piektā piedēkļa gilka funkcijas joprojām ir maz pētītas, bet gan atšķirība starp dažādām tRNS molekulām.
tRNS tretīna struktūra tas ir kompaktāks un ir nosēdināts ar stabilās lapas okremiju tuvināšanas ceļu papildu ūdens saišu liniem ar L veida struktūras šķīdumiem "Liktovogo zginu". Ar kuru akceptora sviru, kas saistās ar aminoskābi, mēs izkliedējam vienā molekulas galā, bet antikodonu otrā.

tRNS tretīna struktūra (autors A.S. Spirin)
Budova rRNS un ribosoma . Ribosomu RNS veido pamatu, ar kuru ribosomu izveidošanas laikā tiek saistīti specifiski proteīni. Ribosomas- Ce nukleoproteīna organellas, kas nodrošina proteīna sintēzi uz mRNS. Klitz ribosomu skaits ir vēl lielāks: no 104 prokariotiem līdz 106 eikariotiem. Tos lokalizē ribosomas galvas vietā citoplazmā, eikariotos, turklāt kodolā, mitohondriju matricā un hloroplastu stromā. Ribosomas sastāv no divām apakšdaļām: lielas un mazas. Pēc izmēra un molekulmasas visas ribosomas ir sadalītas 3 grupās - prokariotu 70S ribosomas (S-sedimentācijas koeficients), kuras sastāv no mazām 30S un lielām 50S apakšdaļām; Eikariotu 80S ribosomas, kas sastāv no 40S mazām un 60S lielām apakšvienībām.
Maza apakšnodaļa 80S ribosoma ir piepildīta ar vienu rRNS molekulu (18S) un 33 dažādu proteīnu molekulām. Lieliska apakšsadaļa trioma sastāv no rRNS molekulām (5S, 5.8S un 28S) un aptuveni 50 proteīniem.
rRNS sekundārā struktūra utvoryutsya aiz īsām divpavedienu molekulas sekcijām - matadatas (apmēram 2/3 rRNS), 1/3 - attēlo viennozīmīgi sižeti, kas bagāts ar purīna nukleotīdiem.
Asistents. Neatkarīgi no tiem, kam tRNS ir nozīmīga, rozpovid par її budova, it īpaši, ka funkcionēšana ir pelnījusi okremiya rasdіl.
Vēlāk tRNS ir "adapteris", kas vienā no saviem noteikumiem atpazīst ģenētiskā koda triliterālo secību, kas padara to par vienu aminoskābi, kas ir fiksēta otrā tRNS galā. Ziņojuma RNS augšpusē un transporta RNS galā atrodas 3 nukleotīdi antikodons. Tikai antikodona komplementaritātes laikā ar pārneses RNS mRNS nesēju var nonākt pie tā. Alternatīvi, tRNS nevar iekļūt mRNS pati, tai nepieciešama ribosomu palīdzība, jo tā ir to mijiedarbības vieta, kā arī aktīvs translācijas dalībnieks. Piemēram, pati ribosoma rada saites starp aminoskābēm, ko ienes tRNS, veidojot proteīna lancetiņu.
tRNS būtības īpatnības ir apzīmētas ar ģenētisko kodu, lai proteīns, kas atrodas aiz gēna, valda, lai tiktu nolasīta transporta RNS. Šis kods tiek praktizēts uz Zemes mītošajai ādas slimībai: vīrusa radīšanu pieraksta tie paši triliterālie kodoni, kas rakstīti, lai ierakstītu delfīna “locīšanas instrukcijas”. Eksperimentāli pārbaudīts, ka vienas dzīvās dabas gēni, kas ievietoti citas šūnās, tiek kopēti un pārvērsti olbaltumvielās, it kā neizskatās pēc gēniem, kas rodas valdnieka šūnās. Uz ģenētiskā koda vienveidību balstās insulīna modificēto zarnu nūju koloniju veidošanās un citu cilvēka enzīmu bagātība, kas ir uzvaroša kā vēstules cilvēkiem, kuru organisms nav dzīvotspējīgs vai trūkst. Neatkarīgi no acīmredzamās atšķirības starp cilvēku un zarnu nūju, cilvēku proteīni tiek viegli izveidoti aiz jogas krēsliem, lai palīdzētu zarnu nūju šķēpa aparātam. Nav pārsteidzoši, ka dažādu avotu transporta RNS tiek atpazītas vēl mazāk.

Ādas kodons no šī saraksta stopkodoni, kas dod signālu par tulkošanas pabeigšanu, var atpazīt pēc pārneses RNS. Lai iegūtu papildu palīdzību antikodona ievadīšanai matricas RNS, ko var saistīt tikai ar vienu kodonu no saraksta, ir nepieciešama atpazīšana, ka tRNS var atpazīt tikai vienu kodonu. Turklāt klitinijā ir tikai 61 šo molekulu suga. Patiešām, tas ir vairāk vērts, jo noteiktās situācijās matricas RNS nolasīšanai nepietiek tikai ar mātes antikodona izmantošanu: ir jāmeklē citi prāti, iespējams, ka tiek radīta īpaša modificēta tRNS.
No pirmā acu uzmetiena TRNA Mayo riosnomanitāte ir apraides procesa novērtējums: Adja Kozhna Zikh molekulas, kas nodrošina matricas RNS pidda ribosomas pārnešanu uz viņa paša antikodonu, dižciltīgā stacijām, truša mandāts, mandāta mandāts Un evolūcijas rezultātā izveidojās tie paši klinālie mehānismi, kas palīdzētu šīm problēmām. Piemēram, ādas sugu tRNS skaits klitinijā norāda, ka bieži vien aminoskābe, kuras sugā nav, ir iestrādāta proteīnos, kas būs. Є aminoskābes, kas reti ir uzvaras, un bieži vien ir uzvaras, un nenesošo tRNS skaits bija vienāds, ievērojami atvieglojot olbaltumvielu locīšanu. Tāpēc klitinijā ir maz “attiecīgo” aminoskābju un līdzīgu tRNS, un tās, kas bieži palielinās, vibrē lielā skaitā.

Ar šādu tRNS molekulu klāstu visas smakas ir līdzīgas, kas, skatoties uz to ikdienas funkcijām, lielākoties ir mazāk smagas visiem rīsu veidiem. Ja paskatās uz tRNS trivimēru shēmu, jūs redzat daudz atomu kaudzes. Ir zināms, ka otrimana molekula ir salocīta garas lancetes nukleotīda krokas rezultātā, taču tā to dara pati.
Ir iespējams veikt її adopcijas posmu, sākot no pirmā: nukleotīdu secības locīšana ar RNS polimerāzi ir līdzīga gēnam, lai noņemtu informāciju par doto pārneses RNS. Tiek izsaukta secība pēc viena no šiem nukleotīdiem un to skaita tRNS primārā struktūra. Šķiet, ka tRNS primārā struktūra ir kodēta gēnā, ko nolasa RNS polimerāze. Tā vietā primārā struktūra ir vienlīdz vienkāršu viena veida molekulu secība, ieskaitot salocītu, salocītu polimēra molekulu. Piemēram, proteīna molekulas primārā struktūra ir vienkārša noliktavas aminoskābju secība.

Neatkarīgi no tā, cik daudz nukleotīdu lancetes, jūs nevarat būt klišejā pie rūcoša stāna, tikai stiepjoties pie līnijas. Nukleotīdu malās jau ir bagātīgi pozitīvi un negatīvi lādētas daļas, kas vienkārši veido ūdens saites pa vienai. Par to, kā tiek izveidotas vienas un tās pašas saites starp divu DNS molekulu nukleotīdiem, sasaistot tās ar vītnes spirāli, ir aprakstītas, un, lai iegūtu sīkāku informāciju par ūdens saitēm, varat doties uz. Ūdens saites ir mazākas, zemākas saites starp atomiem molekulās, taču joprojām ir pietiekami, lai himēriski savītu tRNS un apgrieztu її šajā pozīcijā. Saišu mugurkauls ir nosēdināts tikai ar dažiem aktīviem nukleotīdiem, salokot attēlā redzamo tRNS uz stabilās lapas radzes. Rezultātā vālītes balsenes sauc sekundārā struktūra tRNS. Zlīva shēmā redzams, ka aktīvos nukleotīdus saista ūdens saites, pretējā gadījumā tie ir piepildīti ar nepāra saitēm, veidojot gredzenus un cilpas. Atšķirības starp dažādu tRNS sugu sekundāro struktūru ir saistītas ar atšķirībām to primārajā struktūrā. Tas parādās dažādā "stabilo lapu" vai "kātiņa" garumā nukleotīdu ārējās lancetes dažāda garuma spalvām.
Otrā atšķirība dažādu tRNS primārajā struktūrā un tām, kurām ir vienādi nukleotīdi noteiktās smakas pozīcijās (shēmā horizontālajās līnijās ir norādītas ar to nosaukumu pirmajiem burtiem), lielāks nukleotīdu skaits dažādās tRNS atšķiras viens no otra. Visām tRNS ir ieviesta pilnīgāka shēma, tāpēc apspriestie nukleotīdi ir norādīti ar cipariem.
tRNS galvas funkcionālās daļas є:
=) antikodons, lai nukleotīdu secība būtu komplementāra vienam matricas RNS kodonam, kas atrodams antikodona matadata
=) akceptoru kinets, Cik lielā mērā drīkst pievienot aminoskābi. Vіn znahoditsya protilezhny sānu vіd antikodonovoї matadata.
Faktiski sākotnējā tRNS neizskatās tā, kā izskatās pēc sekundārās struktūras shēmas, tāpēc tās izveidošanas nolūkā tika apvienoti tikai daži nukleotīdi, un reshta tika atstāti nesapāroti. Lai nokārtotos ūdens saites starp nukleotīdiem no dažādām staļļa lapas daļām, dzīslas saritinās tālu, bagātīgi salocoties. terciārā struktūra burta L formā. Var saprast, ka pašas sekundārās struktūras daļas bija saliektas, lai pieņemtu terciāru, uzliekot krāsas zemāk esošajās diagrammās. Antikodona matadata, kas apzīmēta ar melnbaltām krāsām, ir atstāta apakšā (atmiņas kārpu, kas ir “apakšā”, ir jāsaprot: vizuāli attēlo pašu tRNS tik plašā orientācijā proteīna translācijas shēmās), un akceptora gals (dzeltens gredzens) ir saliekts.

Pati tRNS izskatās šādi, it kā tā būtu gatava pirms aminoskābju pievienošanas. Pašsavienošanās ar aminoskābju tRNS nav iespējama, kam nepieciešama īpaša enzīma līdzdalība: aminoacil-tRNS sintetāze. Sintetāzes sugu skaits klitīnās mainās atkarībā no tRNS sugu skaita.
Visu veidu tRNS formu vienprātība ir nepieciešama, lai ribosoma varētu atpazīt, vai tās ir, pieņemt to nūjas ar mRNS, pārvietoties no vienas vietas uz otru. Dažādi tRNS veidi tika sporādiski mainīti pa vienam, kas atviegloja ribosomas darbu, kritiski mainot olbaltumvielu sintēzes ātrumu. Dabiskās sugas šādā veidā ir vērstas uz tām, kas padara tRNS līdzīgas viena otrai. Bet tajā pašā laikā otrs faktors, kas ietekmē plankumu rašanos starp dažādiem tRNS veidiem: ir arī jāatpazīst ādas tips un jaunajai vienībai jāpievieno aminoskābe, kas to parādīs. Ir skaidrs, ka atpazīšanas vērtības var būt buti hoch un piemiņas, bet nav nepieciešamas, tāpēc darbs ar tRNS veidu atpazīšanu tiek pārveidots par rotaslietu procesu. Tajā pašā laikā, visticamāk, tiek izmantotas aminoacil-tRNS-sintetāzes: to āda var saistīties tikai ar vienu no 20 aminoskābēm, un tās var arī pievienot šāda veida tRNS, piemēram, aminoskābes. No tabulas ar ģenētisko kodu var redzēt, ka ādas aminoskābi kodē decimālā nukleotīdu secība, tāpēc, piemēram, visas tRNS ar antikodoniem CGA, CGG, CGU un CGC atpazīs viens un tas pats. sintetāze, kas ir pirms tiem alanīns. Tādus procesus ar vienu tRNS sintetāzi sauc strīdīgs.
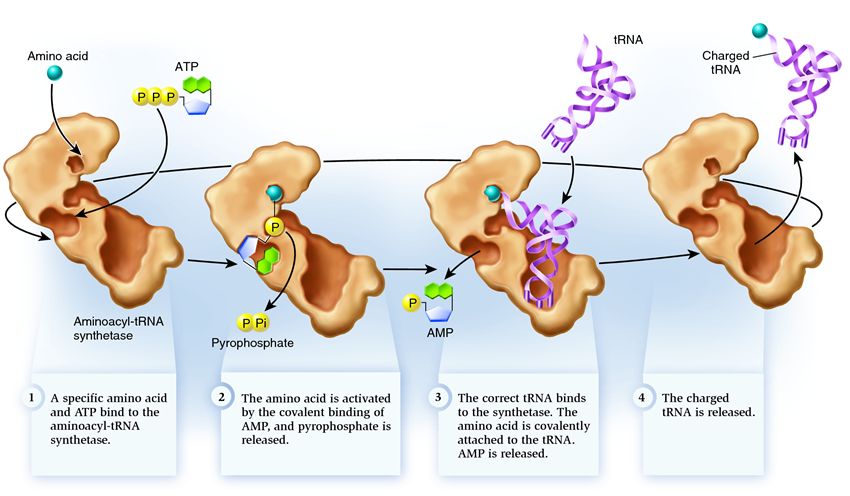
Sintetāze pieder pie enzīmu grupas, kuras funkcija ir saistīta ar saistīšanos ar citām molekulām un to apvienošanu vienā:
1 . sintetāze patērē aminoskābi un ATP molekulu. ATP formā tiek ievadītas divas fosfātu grupas, kas rada enerģiju, kas nepieciešama aizskarošai darbībai. Adenozīna monofosfāts (AMP), kas atstāts sagrautas molekulas veidā, pievienojas aminoskābei, sagatavojot to savienošanai ar akceptora matadatu.
2 . sintetāze ņem vienu no dažādajām sporadnes tRNS aminoskābju ķēdēm.

Šajā posmā ir nepieciešama atkārtota transporta RNS sintetāzes veida pārbaude. Іsnuє kіlka atpazīšanas metodes, un ādas sintetāze є їх ir unikāla kombinācija. Mijiedarbība starp tRNS sintetāzi ietver vismaz vienu nukleotīdu pret antikodonu. Akceptora matadata ir atkarīga arī no apvērsuma: tā parāda specifisku nukleotīdu klātbūtni, kas ir būtiski sporādisko tRNS nepieciešamajām aminoskābēm. Arī citu tRNS daļu nukleotīdi var piedalīties gēnu transformācijā pa vienam no galvenajām sintetāzes vietām. Nepareiza tRNS var augt atbilstoši dažu parametru nepieciešamībai, bet neprecīzas palaišanas rezultātā tā var pareizi un nedaudz sintetizēt, viegli sadaloties. Un pareizā tRNS ātri un viegli pielīp pie sintetāzes, pēc kā mainās sintetāzes struktūra, uzsākot procesu aminoacilēšana lai tRNS pievienotu aminoskābes

3 . aminoacilēšana iedarbojas uz sajauktās AMP molekulas aizstāšanu ar aminoskābi vienā tRNS molekulā. Pēc AMP aizstāšanas sintetāze tiek izsmelta, un tRNS tiek apgriezta pārējai aminoskābju konversijai. Ja pievienotā aminoskābe tiek atpazīta kā nepareiza, tā tiks atpazīta kā tRNS, aminoskābes trūkst sporu sintetāzē un tur var tikt pievienota cita molekula. Jaunā aminoskābe ir izgājusi ATP un tRNS konversijas stadiju, un, iespējams, tā būs jāpārvērš. Lai gan apžēlošana nebija atļauta, tRNS ir uzlādēta ar aminoskābi: tā ir gatava spēlēt savu lomu olbaltumvielu translācijā. Un sintetāze ir gatava uzņemt jaunas aminoskābes un tRNS, un cikls sāksies no jauna.
Ja aminoacil-tRNS-sintetāzes darbs ir pareizs, tas ir pārāk bagāts, lai nogulsnētu: ja šajā posmā būs kļūda, tad tRNS tiks pievienota nepareiza aminoskābe. Tas tiks ievadīts proteīnā, kas aug uz ribosomas, pat tRNS un ribosoma nefunkcionē kā kodons un aminoskābju maiņa. Apžēlošanas sekas var būt nenozīmīgas vai katastrofālas, un dabiskās atlases gaitā ar enzīmiem, kas neietekmē šādu reversu funkcijas, tās būs svarīgākas, kas var radīt dažādas iespējas noteikt pareizību starp aminoskābēm un tRNS. Tāpēc mūsdienu šūnās sintetāze savienojas ar nepareizu aminoskābi vidēji vienā pilē 50 tūkstošus un ar vieglu tRNS vairāk nekā vienu reizi 100 tūkstošos dienu.

The deyakі amіnokisly vіdіznyayutsya viens vіd viens vairāk nekā viens atomu skaits. Paskatieties uz viņu shēmām, kļūst acīmredzams, ka iespēja sajaukt arginīnu ar alanīnu ir daudz mazāka vai sajaukt izoleicīnu ar leicīnu vai valīnu. Tāpēc ādas sintetāzei, kas saistās ar līdzīgām aminoskābēm, var būt papildu mehānismi apvēršanai. Ass ir šādas piesaistes piemērs izoleicīna-tRNS sintetāzē:

Tiek izmantota ādas sintetāze sintētiskais centrs, Kurā tRNS tiek pievienotas aminoskābes. tRNS akceptora matadata, ko ieslodzījusi sintetāze, pati to patērē, tāpat kā aminoskābi, ir gatava no tās iesaistīties reakcijā. Šo sintetāžu darbība tiks pārtraukta, tiklīdz tiks ražotas aminoskābes un tRNS. Ale Ile-tRNS-sintetāze var veicināt apžēlošanas efektu, izmantojot citas aminoskābes, kas līdzīgas izoleicīnam. Tas ir viss korekcijas centrs: Nosauciet vīnu lomu tRNS un aminoskābju veidošanās procesā. Mazais attēls labajā pusē parāda, ka akceptora tRNS matadata gala stāvoklis Ile-tRNS sintetāzes sintētiskajā centrā rada nedabisku matadatu. Tims nav mazāks, sintetāzes utrimu tRNS šajā pozīcijā, līdz aminoskābe nonāk pie tā. Pēc tam, kā tas notika, nepieciešamība ievietot akceptora matadatu sintētiskajā centrā ir izsmelta, un tRNS tiek iztaisnota, patērējot tās galu ar korekcijas centru, kas uzstādīts uz jaunās aminoskābes.

Acīmredzot sintētiskais centrs arī spēlē savu lomu aminoskābju uzsūkšanā, kas nav piemērotas sintetāzei. Lai to iztērētu līdz pēdējam, molekulām jāatbilst vairākiem prātiem, mātes krēms ir nemitīga izplešanās. Neatkarīgi no tiem, kas leicīns un izoleicīns atriebj vienu un to pašu atomu skaitu, leicīns ir lielāks, pateicoties klātbūtnei plašajā struktūrā. Tāpēc vīns nevar iekļūt sintētiskajā centrā, bet šķiet, ka tas ir iespējams kompaktajam izoleicīnam, un ir viegli redzēt Ile-tRNS sintetāzi.
Un valīna ass, kas ir vissvarīgākā no šīm trim molekulām ar līdzīgu atomu struktūru, viegli aizņem izoleicīna vietu sintētiskajā centrā, un sintetāze nonāk tRNS. Pati šādā veidā iekļūt sintetāzes grupas korekcijas centrā. Kā akceptora matadata, kas iztaisnojas, tiek pareizi uzlādēta un satur izoleicīnu, tā nevar izspiesties cauri korekcijas centra centram: tā vienkārši ir pārāk maza molekulas izmēram. Šādā secībā tRNS, kas ir iztaisnojusies, vairs neko nesagriež, un tā iznāks no sintetāzes. Un no šejienes uz tRNS tiek pievienots valīns, vēnas ieslīd korekcijas centrā, un ar to no sintetāzes tiek iegūta tRNS. Šāds transcendentāls tRNS pārsaistīšanās trīskāršs tiek izmantots sintetāzei ar apžēlošanas signālu, mainot tā plašo konfigurāciju. Kā rezultātā:
=) valīns tiek atbrīvots no tRNS un tiek noņemts no sintetāzes
=) akceptora tapa griežas uz sintētisko centru, laužot aminoskābi
=) sintetāze parādās ar jaunu aminoskābi, "uzlādē" savu tRNS un atkārtoti pārbauda, vai tas ir tas pats izoleicīns.
Šādu zemādas atpazīšanas mehānismu implantē citas sintetāzes.







