Будова та функції рНК. Транспортна РНК. Будова, функції. Схема будови молекули т рнк
Є синтез білкової молекули з урахуванням матричної РНК (трансляція). Однак, на відміну від транскрипції, нуклеотидна послідовність не може бути переведена в амінокислотну напряму, оскільки ці сполуки мають різну хімічну природу. Тому для здійснення трансляції потрібен посередник у вигляді транспортної РНК (тРНК), функція якого полягає у перекладі генетичного коду на "мову" амінокислот.
Загальна характеристика транспортної РНК
Транспортні РНК або тРНК - це невеликі молекули, які доставляють амінокислоти до місця синтезу білка (рібосоми). Кількість цього виду рибонуклеїнової кислоти у клітині становить приблизно 10 % від загального пулу РНК.
Як і інші різновиди тРНК складається з ланцюжка рибонуклеозидтрифосфатів. Довжина нуклеотидної послідовності налічує 70-90 ланок, і близько 10% складу молекули посідає мінорні компоненти.
Через те, що кожній амінокислоті відповідає свій переносник як тРНК, клітина синтезує велику кількість різновидів цієї молекули. Залежно від виду живого організму, цей показник варіює від 80 до 100.
Функції тРНК
Транспортна РНК є постачальником субстрату для синтезу білка, який відбувається в рибосомах. За рахунок унікальної здатності зв'язуватися і з амінокислотами, і з матричною послідовністю тРНК виконує функцію смислового адаптера під час перекладу генетичної інформації з форми РНК у форму білка. Взаємодія такого посередника з матрицею, що кодує, як у транскрипції, засноване на принципі комплементарності азотистих основ.
Головна функція тРНК полягає в акцептуванні амінокислотних ланок та їхньому транспортуванні в апарат білкового синтезу. За цим технічним процесом стоїть величезний біологічний сенс – реалізація генетичного коду. Здійснення цього процесу ґрунтується на наступних особливостях:
- усі амінокислоти кодуються триплетами нуклеотидів;
- для кожного триплету (або кодону) існує антикодон, що входить до складу тРНК;
- кожна тРНК може зв'язатися лише з певною амінокислотою.

Таким чином, амінокислотна послідовність білка визначається тим, які тРНК та в якому порядку будуть комплементарно взаємодіяти з матричною РНК у процесі трансляції. Це можливо завдяки наявності у транспортній РНК функціональних центрів, один з яких відповідає за вибіркове приєднання амінокислоти, а інший – за зв'язування з кодоном. Тому функції тісно взаємопов'язані.
Будова транспортної РНК
Унікальність тРНК у тому, що її молекулярна структура не лінійна. Вона включає спіральні дволанцюжкові ділянки, які називають стеблами, і 3 одноланцюгові петлі. За формою така конформація нагадує конюшинний лист.
У структурі тРНК розрізняють такі стебла:
- акцепторний;
- антикодоновий;
- дигідроуридиловий;
- псевдоуріділовий;
- додатковий.
Подвійні спіралі стебел містять від 5 до 7 Уотсон-Кріксонівських пар. На кінці акцепторного стебла розташований невеликий ланцюжок неспарених нуклеотидів, 3-гідроксил якого є місцем прикріплення відповідної молекули амінокислоти.

Структурною областю для з'єднання з мРНК є одна з петель тРНК. Вона містить антикодон, комплементарний смисловому триплету саме антикодон і акцептуючий кінець забезпечують адапторну функцію тРНК.
Третинна структура молекули
" Конюшинний лист " є вторинною структурою тРНК, проте за рахунок фолдингу молекула набуває L-подібну конформацію, яка скріплюється додатковими водневими зв'язками.
L-форма є третинною структурою тРНК і складається з двох практично перпендикулярних А-РНК спіралей, що мають довжину 7 нм і товщину 2 нм. Така форма молекули має лише 2 кінця, одному з яких розташований антикодон, але в іншому - акцепторний центр.

Особливості зв'язування тРНК з амінокислотою
Активацію амінокислот (їх приєднання до транспортної РНК) здійснює аміноацил-тРНК-синтетаза. Цей фермент одночасно виконує 2 важливі функції:
- каталізує утворення ковалентного зв'язку між 3`-гідроксильною групою акцепторного стебла та амінокислотою;
- забезпечує принцип виборчої відповідності.
Для кожної з них є своя аміноацил-тРНК-синтетаза. Вона може взаємодіяти лише з відповідним видом транспортної молекули. Це означає, що антикодон останньої має бути комплементарним триплету, що кодує саме цю амінокислоту. Наприклад, синтетаза лейцину з'єднуватиметься тільки з призначеним для лейцину тРНК.
У молекулі аміноацил-тРНК-синтетази є три нуклеотид-зв'язувальні кишені, конформація та заряд яких комплементарні нуклеотидам відповідного антикодону в тРНК. Таким чином, фермент визначає необхідну транспортну молекулу. Набагато рідше фрагментом розпізнавання є нуклеотидна послідовність акцепторного стебла.
РНК- полімер, мономерами якої є рибонуклеотиди. На відміну від ДНК, РНК утворена не двома, а одним полінуклеотидним ланцюжком (виняток - деякі РНК-віруси мають дволанцюгову РНК). Нуклеотиди РНК здатні утворювати водневі зв'язки між собою. Ланцюги РНК значно коротші за ланцюги ДНК.
Мономер РНК – нуклеотид (рибонуклеотид)- складається із залишків трьох речовин: 1) азотистої основи, 2) п'ятивуглецевого моносахариду (пентози) та 3) фосфорної кислоти. Азотисті основи РНК також відносяться до класів піримідинів та пуринів.
Піримидинові основи РНК – урацил, цитозин, пуринові основи – аденін та гуанін. Моносахарид нуклеотиду РНК представлений рибозою.
Виділяють три види РНК: 1) інформаційна(матрична) РНК – іРНК (мРНК), 2) транспортнаРНК – тРНК, 3) рибосомнаРНК – рРНК.
Всі види РНК є нерозгалуженими полінуклеотидами, мають специфічну просторову конформацію і беруть участь у процесах синтезу білка. Інформація про будову всіх видів РНК зберігається у ДНК. Процес синтезу РНК на матриці ДНК називається транскрипцією.

Транспортні РНКмістять зазвичай 76 (від 75 до 95) нуклеотидів; молекулярна маса - 25 000-30 000. На частку тРНК припадає близько 10% від загального вмісту РНК у клітині. Функції тРНК: 1) транспорт амінокислот до місця синтезу білка, рибосом, 2) трансляційний посередник. У клітині зустрічається близько 40 видів тРНК, кожен із них має характерну лише йому послідовність нуклеотидів. Однак у всіх тРНК є кілька внутрішньомолекулярних комплементарних ділянок, через які тРНК набувають конформації, що нагадує формою лист конюшини. Будь-яка тРНК має петлю для контакту з рибосомою (1), антикодонову петлю (2), петлю для контакту з ферментом (3), акцепторне стебло (4), антикодону (5). Амінокислота приєднується до 3"-кінця акцепторного стебла. Антикодон- Три нуклеотиди, що «пізнають» кодон іРНК. Слід підкреслити, що конкретна тРНК може транспортувати певну амінокислоту, що відповідає її антикодону. Специфічність сполуки амінокислоти та тРНК досягається завдяки властивостям ферменту аміноацил-тРНК-синтетазу.
Рибосомні РНКмістять 3000-5000 нуклеотидів; молекулярна маса - 1000000-1500000. На частку рРНК припадає 80-85% від загального вмісту РНК в клітині. У комплексі з рибосомними білками рРНК утворює рибосоми – органоїди, які здійснюють синтез білка. В еукаріотичних клітин синтез рРНК відбувається в ядерцях. Функції рРНК: 1) необхідний структурний компонент рибосом та, таким чином, забезпечення функціонування рибосом; 2) забезпечення взаємодії рибосоми та тРНК; 3) початкове зв'язування рибосоми та кодона-ініціатора іРНК та визначення рамки зчитування; 4) формування активного центру рибосоми.
Нуклеїнові кислоти - високомолекулярні речовини, що складаються з мононуклеотидів, які з'єднані один з одним у полімерний ланцюжок за допомогою 3",5"- фосфодіефірних зв'язків і упаковані в клітинах певним чином.
Нуклеїнові кислоти - біополімери двох різновидів: рибонуклеїнова кислота (РНК) та дезоксирибонуклеїнова кислота (ДНК). Кожен біополімер складається з нуклеотидів, що розрізняються по вуглеводному залишку (рибозе, дезоксирибозе) та одному з азотистих основ (урацил, тимін). Відповідно до цих відмінностей нуклеїнові кислоти і отримали свою назву.
Структура рибонуклеїнової кислоти
Первинна структура РНК
Молекула РНКє лінійні (тобто нерозгалужені) полінуклеотиди з аналогічним ДНК принципом організації. Мономерами РНК є нуклеотиди, що складаються з фосфорної кислоти, вуглеводу (рибози) та азотистої основи, з'єднані 3", 5"-фосфодіефірними зв'язками. Полінуклеотидні ланцюги молекули РНК полярні, тобто. мають помітні 5'- і 3"-кінці. При цьому, на відміну від ДНК, РНК є одноланцюжковою молекулою. Причиною такої відмінності є три особливості первинної структури:- РНК, на відміну від ДНК, містить замість дезоксирибози рибозу, яка має додаткову гідроксигрупу. Гідроксигрупа робить дволанцюжкову структуру менш компактною
- Серед чотирьох головних, або мажорних, азотистих основ (А, Г, Ц та У) замість тиміну міститься урацлл, який відрізняється від тиміну лише відсутністю метильної групи в 5-му положенні. Завдяки цьому зменшується сила гідрофобної взаємодії у комплементарній парі A-У, що теж знижує ймовірність утворення стійких дволанцюжкових молекул.
- Нарешті, у РНК (особливо у тРНК) високо зміст т. зв. мінорних основ та нуклеозидів. Серед них дигідроуридин (в урацилі немає одного подвійного зв'язку), псевдоуридин (урацил інакше, ніж зазвичай, пов'язаний з рибозою), диметиладенін та диметилгуанін (в азотистих підставах по дві додаткові метильні групи) та багато інших. Майже всі ці підстави що неспроможні брати участь у комплементарних взаємодіях. Так, метильні групи в диметиладеніні (на відміну від тиміну та 5-метилцитозину) знаходяться при такому атомі, який у парі A-У утворює водневий зв'язок; отже, тепер цей зв'язок замкнутися неспроможна. Це теж перешкоджає утворенню дволанцюгових молекул.
Таким чином, широко відомі відмінності складу РНК від ДНК мають величезне біологічне значення: адже свою функцію молекули РНК здатні виконувати тільки в одноланцюжковому стані, що найбільш очевидно для мРНК: важко уявити, як би могла дволанцюжкова молекула транслюватися рибосомами.
Разом з тим, залишаючись одиночною, у деяких ділянках ланцюг РНК може утворювати петлі, виступи або "шпильки" з дволанцюжковою структурою (рис.1.). Ця структура стабілізована взаємодією основ у парах А::У та Г:::Ц. Однак можуть утворюватися і "не правильні" пари (наприклад, Г У), а в деяких місцях "шпильки" і взагалі не відбувається жодної взаємодії. У складі таких петель може утримуватися (особливо у тРНК та рРНК) до 50 % усіх нуклеотидів. Загальний вміст нуклеотидів в РНК варіює від 75 одиниць до багатьох тисяч. Але навіть найбільші РНК на кілька порядків коротші за хромосомні ДНК.
Первинна структура мРНК скопійована з ділянки ДНК, що містить інформацію про первинну структуру поліпептидного ланцюга. Первинна структура інших типів РНК (тРНК, рРНК, рідкісні РНК) є остаточною копією генетичної програми відповідних генів ДНК.
Вторинна та третинна структури РНК
Рибонуклеїнові кислоти (РНК) – однониткові молекули, тому на відміну від ДНК їх вторинна та третинна структури нерегулярні. Ці структури, що визначаються як просторова конформація полінуклеотидного ланцюга, формуються в основному за рахунок водневих зв'язків та гідрофобних взаємодій між азотистими основами. Якщо для молекули нативної ДНК характерна стійка спіраль, то структура РНК різноманітна і лабільна. Рентгеноструктурний аналіз показав, що окремі ділянки полінуклеотидного ланцюга РНК, перегинаючись, навиваються на себе з утворенням внутрішньоспіральних структур. Стабілізація структур досягається за рахунок комплементарних спарювань азотистих основ антипаралельних ділянок ланцюга; специфічними парами тут є А-U, G-С і, рідше, G-U. Завдяки цьому молекулі РНК виникають як короткі, і протяжні біспіральні ділянки, що належать однієї ланцюга; ці ділянки звуться шпильок. Модель вторинної структури РНК зі шпилькоподібними елементами була створена в кінці 50-х - на початку 60-х рр. ХХ ст. в лабораторіях А. С. Спіріна (Росія) та П. Доті (США).
| Деякі види РНК | ||
| Види РНК | Розмір у нуклеотидах | Функція |
| gРНК – геномні РНК | 10000-100000 | |
| mРНК – інформаційні (матричні) РНК | 100-100000 | передає інформацію про структуру білка з молекули ДНК |
| tPHK - транспортні РНК | 70-90 | транспортує амінокислоти до місця синтезу білка |
| rРНК - рибосомні РНК | кілька дискретних класів від 100 до 500 000 | міститься в рибосомах, бере участь у підтримці структури рибосоми |
| sn-PHK – мала ядерна РНК | 100 | видаляє інтрони та ферментативно з'єднує екзони у мРНК. |
| sno-РНК - мала ядерцева РНК | бере участь у напрямку або проведенні модифікацій основ у рРНК та малій ядерній РНК, таких, як, наприклад, метилювання та псевдоуридинізація. Більшість малих ядерцевих РНК перебувають у інтронах інших генів | |
| srp-РНК - сигнал, що розпізнає РНК | розпізнає сигнальну послідовність білків, призначених для експресії, та бере участь у їх перенесенні через цитоплазматичну мембрану | |
| mi-РНК - мікро-РНК | 22 | контролюють трансляцію структурних генів шляхом комплементарного зв'язування з 3"-кінцями нетрансльованих ділянок іРНК |
Утворення спіральних структур супроводжується гіпохромним ефектом – зменшенням оптичної густини зразків РНК при 260 нм. Руйнування цих структур відбувається при зниженні іонної сили розчину РНК або його нагріванні до 60-70 °З; воно також називається плавленням і пояснюється структурним переходом спіраль – хаотичний клубок, що супроводжується збільшенням оптичної густини розчину нуклеїнової кислоти.
У клітинах існує кілька типів РНК:
- інформаційна (або матрична) РНК (іРНК або мРНК) та її попередниця - гетерогенна ядерна РНК (г-я-РНК)
- транспортна РНК (т-РНК) та її попередниця
- рибосомна (р-РНК) та її попередниця
- мала ядерна РНК (sn-PHK)
- мала ядерцева РНК (sno-PHK)
- сигналрозпізнавальна РНК (srp-PHK)
- мікро-РНК (mi-PHK)
- Мітохондріальна РНК (т + РНК).

Гетерогенна ядерна та інформаційна (матрична) РНК
Гетерогенна ядерна РНК властива виключно еукаріотів. Вона є попередницею інформаційної РНК (і-РНК), яка переносить генетичну інформацію від ядерної ДНК до цитоплазми. Гетерогенна ядерна РНК (премРНК) відкрита радянським біохіміком Г. П. Георгієвим. Кількість видів г-я-РНК дорівнює кількості генів, так як вона служить прямою копією послідовностей, що кодують геному, внаслідок чого має копії паліндромів ДНК, тому її вторинна структура містить шпильки і лінійні ділянки. У процесі транскрипції РНК із ДНК ключову роль грає фермент РНК-полімераза II.
Інформаційна РНК утворюється в результаті процесингу (дозрівання) г-я-РНК, при якому відбуваються відсікання шпильок, вирізування ділянок (інтронів), що не кодують, і склеювання кодуючих екзонів.
Інформаційна РНК (і-РНК) є копією певної ділянки ДНК і виконує роль переносника генетичної інформації від ДНК до місця синтезу білка (рибосоми) і бере участь безпосередньо в складання його молекул.
Зріла матрична РНК має кілька областей із різною функціональною роллю (рис.)
- на 5"-кінці знаходиться т.зв. "ковпачок" або кеп - ділянка з одного-чотирьох модифікованих нуклеотидів. Така структура захищає 5"-кінець м-РНК від ендонуклеаз
- за "ковпачком" йде 5"-нетрансльована область - послідовність з декількох десятків нуклеотидів. Вона комплементрана одному з відділів тієї р-РНК, яка входить у малу субодиницю рибосоми. За рахунок цього вона служить для первинного зв'язування м-РНК з рибосомою, але сама не транслюється
- ініціюючий кодон - АУГ, що кодує метіонін. У всіх м-РНК ініціюючий кодон є однаковим. З нього починається трансляція (зчитування) м-РНК. Якщо після синтезу пептидного ланцюга метіонін не потрібен, він, як правило, відщеплюється з його N-кінця.
- За ініціюючим кодоном слідує кодуюча частина, що містить інформацію про послідовність амінокислот у білку. У еукаріотів зрілі м-РНК є моноцистронними, тобто. кожна з них несе інформацію про структуру лише одного поліпептидного ланцюга.
Інша справа, що іноді пептидний ланцюг незабаром після утворення на рибосомі розрізається на кілька дрібніших ланцюгів. Так буває, наприклад, при синтезі інсуліну та цілого ряду олігопептидних гормонів.
Кодуюча частина зрілої м-РНК еукаріотів позбавлена інтронів - будь-яких вставних послідовностей, що не кодують. Іншими словами, є безперервна послідовність смислових кодонів, яка повинна читатись у напрямку 5" ->3".
- Після закінчення цієї послідовності знаходиться кодон термінації - один із трьох "безглуздих" кодонів: УАА, УАГ або УГА (див. табл. генетичного коду нижче).
- За цим кодоном може слідувати ще 3"-нетрансльований ділянку, що значно перевищує по довжині 5'-нетрансльовану область.
- Нарешті, майже всі зрілі мРНК еукаріотів (крім гістонових мРНК) на 3"-кінці містять полі(А)-фрагмент із 150-200 аденілових нуклеотидів.
3"-нетрансльований ділянку та полі(А)-фрагмент мають відношення до регуляції тривалості життя м-РНК, оскільки руйнування м-РНК здійснюється 3"-екзонуклеазами. Після закінчення трансляції м-РНК від полі(А)-фрагменту відщеплюються 10-15 нуклеотидів. Коли цей фрагмент вичерпується, починає руйнуватися значна частина мРНК (якщо відсутня 3"-нетрансльована ділянка).
Загальна кількість нуклеотидів у мРНК зазвичай варіює близько кількох тисяч. При цьому на частину, що кодує, іноді може припадати лише 60-70% нуклеотидів.
У клітинах молекули мРНК майже завжди пов'язані з білками. Останні, ймовірно, стабілізують лінійну структуру мРНК, тобто попереджають освіту в частині, що кодує "шпильок". Крім того, білки можуть захищати мРНК від передчасного руйнування. Такі комплекси мРНК із білками іноді називають інформосомами.
Транспортна РНК у цитоплазмі клітини переносить амінокислоти в активованій формі до рибосом, де вони з'єднуються у пептидні ланцюги у певній послідовності, яку задає РНК-матриця (мРНК). В даний час відомі дані про нуклеотидну послідовність більш ніж 1700 видів тРНК із прокаріотичних та еукаріотичних організмів. Всі вони мають спільні риси як у їх первинній структурі, так і у способі складання полінуклеотидного ланцюга у вторинну структуру за рахунок комплементарної взаємодії нуклеотидів, що входять до їх структури.

Транспортна РНК у своєму складі містить не більше 100 нуклеотидів, серед яких відзначається високий вміст мінорних або модифікованих нуклеотидів. Першою повністю розшифрованою транспортною РНК була аланінова РНК, виділена з дріжджів. Аналіз показав, що аланінова РНК складається з 77 нуклеотидів, розташованих у строго визначеній послідовності; до їх складу входять так звані мінорні нуклеотиди, представлені нетиповими нуклеозидами
Аланінова тРНК містить 9 незвичайних основ з однією або декількома метильними групами, які приєднуються до них ферментативним шляхом вже після утворення фосфодіефірних зв'язків між нуклеотидами. Ці підстави нездатні до утворення традиційних пар; можливо, вони служать для того, щоб перешкоджати спаровування основ у певних частинах молекули і таким чином оголювати специфічні хімічні групи, які утворюють вторинні зв'язки з інформаційною РНК, рибосомою або, можливо, з ферментом, необхідним для приєднання певної амінокислоти до відповідної транспортної РНК. Відома послідовність нуклеотидів у тРНК по суті означає, що відома також його послідовність у генах, у яких ця тРНК синтезується. Цю послідовність можна вивести на основі правил специфічного спарювання підстав, встановлених Уотсоном і Криком. У 1970 році була синтезована повна дволанцюжкова молекула ДНК з відповідною послідовністю з 77 нуклеотидів, і виявилося, що вона може бути матрицею для побудови аланінової транспортної РНК. То справді був перший штучно синтезований ген. |
Транскрипція тРНК
Транскрипція молекул т-РНК походить з послідовностей, що кодують її, в ДНК за участю ферменту РНК-полімерази III. У результаті транскрипції формується первинна структура тРНК як лінійної молекули. Формування починається зі складання РНК-полімеразою послідовності нуклеотидів відповідно до гена, що містить інформацію про дану транспортну РНК. Ця послідовність являє собою лінійний полінуклеотидний ланцюг, в якому нуклеотиди йдуть один за одним. Лінійний полінуклеотидний ланцюг є первинною РНК, попередницею тРНК, що включає інтрони - неінформативні надлишки нуклеотидів. У цьому рівні організації пре-тРНК не функціональна. Утворюючись у різних місцях ДНК хромосом пре-тРНК містить надлишки приблизно 40 нуклеотидів порівняно зі зрілою тРНК.
Другим етапом новостворена попередниця тРНК проходить післятранскрипційне дозрівання або процесинг. У ході процесингу видаляються неінформативні надлишки пре-РНК і утворюються зрілі, функціональні молекули РНК.
Процесинг пре-тРНК
Процесинг починається з того, що в транскрибті утворюється внутрішньомолекулярні водневі зв'язки і молекула тРНК набуває форми конюшинного листа. Це вторинний рівень організації тРНК, у якому молекула тРНК ще функціональна. Далі відбувається вирізування неінформативних ділянок з пре-РНК, зрощування інформативних ділянок "розірваних генів" - сплайсинг та модифікація 5"- та 3"-кінцевих ділянок РНК.
Вирізання неінформативних ділянок пре-РНК здійснюється за допомогою рибонуклеаз (екзо- та ендонуклеаз). Після видалення надлишків нуклеотидів відбувається метилювання основ тРНК. Реакція здійснюється метилтрансферазами. У ролі донора метильних груп виступає S-аденозілметіонін. Метилювання перешкоджає руйнуванню тРНК нуклеазами. Остаточно зріла тРНК утворюється шляхом приєднання специфічної трійки нуклеотидів (акцепторного кінця) – ЦЦА, що здійснюється спеціальною РНК-полімеразою.
По завершенні процесингу у вторинній структурі знову утворюються додаткові водневі зв'язки за рахунок яких тРНК переходить на третинний рівень організації та набуває вигляду так званої L-форми. У такому вигляді тРНК іде у гіалоплазму.
Будова тРНК
В основі структури транспортної РНК лежить ланцюжок нуклеотидів. Однак через те, що будь-який ланцюжок нуклеотидів має позитивно і негативно заряджені частини, він не може перебувати в клітині в розгорнутому стані. Ці заряджені частини, притягуючись один до одного, легко утворюють між собою водневі зв'язки за принципом комплементарності. Водневі зв'язки химерно скручують нитку т-РНК та утримують її в такому положенні. В результаті цього вторинна структура т-РНК має вигляд "конюшинного листа" (рис.), Що містить у своїй структурі 4 дволанцюгових ділянки. Високий вміст мінорних або модифікованих нуклеотидів, що відзначаються в ланцюзі тРНК та нездатних до комплементарних взаємодій, формує 5 одноланцюгових ділянок.
Т.ч. вторинна структура т-РНК утворюється внаслідок внутрішньоланцюжкового спарювання комплементарних нуклеотидів окремих ділянок тРНК. Ділянки тРНК, які не залучаються до утворення водневих зв'язків між нуклеотидами, утворюють петлі або лінійні ланки. У тРНК виділяють такі структурні ділянки:
- Акцепторна ділянка (кінець)що складається з чотирьох лінійно розташованих нуклеотидів, три з яких мають у всіх типах тРНК однакову послідовність - ЦЦА. Гідроксил 3"-ВІН аденозину вільний. До нього приєднується карбоксильною групою амінокислота, звідси і назва цієї ділянки тРНК - акцепторний. Пов'язану з 3"-гідроксильною групою аденозину амінокислоту тРНК доставляє до рибосом, де відбувається синтез білка.
- Антикодонова петлязазвичай утворюється сімома нуклеотидами. Вона містить специфічний для кожної тРНК триплет нуклеотидів, який називається антикодоном. Антикодон тРНК за принципом комплементарності випаровується з кодоном мРНК. Кодон-антикодонова взаємодія визначає порядок розташування амінокислот у поліпептидному ланцюгу під час складання її в рибосомах.
- Псевдоуридилова петля (або ТΨС-петля), що складається з семи нуклеотидів і обов'язково містить залишок псевдоуридилової кислоти Припускають, що псевдоуридилова петля бере участь у зв'язуванні тРНК із рибосомою.
- Дигідроурідінова, або D-петля, що складається зазвичай з 8-12 нуклеотидних залишків, серед яких обов'язково є кілька залишків дигідроурідину. Вважають, що D-петля необхідна для зв'язування з аміноацил-тРНК-синтетазою, яка бере участь у впізнанні амінокислотою своєї тРНК (див. "Біосинтез білка"),
- Додаткова петля, Яка варіює за розмірами та складом нуклеотидів у різних тРНК.
Третинна структура т-РНК вже не має форми конюшинного листа. За рахунок утворення водневих зв'язків між нуклеотидами з різних частин "аркуша конюшини" його пелюстки загортаються на тіло молекули і утримуються в такому положенні додатково ван-дер-ваальсові зв'язки, нагадуючи собою форму літери Г або L. Наявність стабільної третинної структури є ще однією особливістю т -РНК, на відміну довгих лінійних полінуклеотидів м-РНК. Зрозуміти, як саме згинаються різні частини вторинної структури т-РНК при утворенні третинної структури можна за рис., зіставивши кольори схеми вторинної та третинної структури т-РНК.


Транспортні РНК (т-РНК) переносять амінокислоти з цитоплазми до рибосоми у процесі синтезу білка. З таблиці з генетичним кодом видно, кожна амінокислота кодується декількома послідовностями нуклеотидів, тому кожній амінокислоті відповідають свої транспортні РНК. Внаслідок цього існує велика різноманітність т-РНК: від одного до шести видів для кожної з 20 амінокислот. Види тРНК, здатні зв'язувати ту саму амінокислоту, називаються ізоакцепторними (наприклад аланін може бути приєднаний до т-РНК, антикодон якої буде комплементований кодонам GCU, GCC, GCA, GCG). Специфіка тРНК позначається верхнім індексом, наприклад: тРНК Ala .
Для процесу синтезу білка головними функціональними частинами т-РНК є: антикодон - послідовність нуклеотидів, що знаходяться на антикодоновій петлі, комплементарний кодону інформаційної РНК (і-РНК) і акцепторна частина - протилежний антикодону кінець т-РНК, до якого приєднується амінокислота. Послідовність основ в антикодоні безпосередньо залежить від виду амінокислоти, прикріпленої до 3"-кінця. Так, наприклад, т-РНК, антикодон якої має послідовність 5"-ЦЦА-3", може нести тільки амінокислоту триптофан. Слід зазначити, що ця залежність лежить в основі передачі генетичної інформації, носієм якої є т-РНК.
У процесі синтезу білка т-РНК антикодон розпізнає трибуквенну послідовність генетичного коду (кодону) і-РНК, зіставляючи їй єдину відповідну амінокислоту, закріплену на іншому кінці тРНК. Тільки у разі комплементарності антикодону до ділянки мРНК транспортна РНК може до неї приєднатися і віддати амінокислоту, що переноситься, на формування протеїнового ланцюжка. Взаємодія т-РНК та і-РНК відбувається у рибосомі, яка також є активним учасником трансляції.
Розпізнавання т-РНК своєї амінокислоти та кодону та-РНК відбувається певним чином:
- Зв'язування "своєї" амінокислоти з т-РНК відбувається за допомогою ферменту - специфічної аміноацил-тРНК-синтетази
Існує велика різноманітність аміноацил-тРНК-синтетаз - за кількістю тРНК, що використовуються амінокислотами. Скорочено їх називають АРСази. Аміноацил-тРНК-синтетази - великі молекули (мол.маса 100 000 - 240 000), що мають четвертинну структуру. Вони специфічно дізнаються про тРНК і амінокислоти і каталізують їх сполуку. Для цього процесу потрібна АТФ, енергія якої використовується на активування амінокислоти з карбоксильного кінця і приєднання її до гідроксилу (3"-ОН) аденозину акцепторного кінця (ЦЦА) тРНК. принаймні три центри зв'язування: для амінокислоти, ізоакцепторних тРНК і АТФ У центрах зв'язування відбувається утворення ковалентного зв'язку, відповідно амінокислоти тРНК, і гідроліз такого зв'язку у разі їх невідповідності (приєднання до тРНК "не тієї" амінокислоти).
АРСази мають здатність вибірково використовувати при впізнанні асортименти тРНК для кожної амінокислоти, тобто. провідною ланкою впізнавання є амінокислота, а до неї підганяється своя тРНК. Далі тРНК шляхом простої дифузії переносить приєднану до неї амінокислоту до рибосом, де відбувається складання білка з амінокислот, що надходять у вигляді різних аміноацил-тРНК.

Зв'язування амінокислоти з тРНК
Зв'язування тРНК та амінокислоти відбувається таким чином (рис.): до аміноацил-тРНК-синтетази приєднується амінокислота та молекула АТФ. Для подальшого аміноацелювання молекула АТФ вивільняє енергію, відщеплюючи дві фосфатні групи. АМФ (аденозинмонофосфат), що залишився, приєднується до амінокислоти, готуючи її до з'єднання з акцепторною ділянкою тРНК - акцепторною шпилькою. Після цього синтетаза приєднує до себе відповідну амінокислоту споріднену тРНК. На цьому етапі відбувається перевірка відповідності синтетазі тРНК. У разі відповідності тРНК щільно приєднується до синтетази, змінюючи її структуру, що призводить до запуску процесу аміноацелювання - приєднання амінокислоти до тРНК.
Аміноацилювання відбувається у процесі заміни приєднаної до амінокислоти молекули АМФ на молекулу тРНК. Після цієї заміни АМФ залишає синтетазу, а тРНК затримується для останньої перевірки амінокислоти.
Перевірка відповідності тРНК приєднаної амінокислоти
Модель синтетази для перевірки відповідності тРНК приєднаної амінокислоти передбачає наявність двох активних центрів: синтетичного та корекційного. У синтетичному центрі відбувається приєднання тРНК до амінокислоти. Акцепторний ділянку тРНК, захопленої синтетазою, спочатку контактує з синтетичним центром, де вже розміщена амінокислота, сполучена з АМФ. Цей контакт акцепторного ділянки тРНК надає йому неприродний вигин до приєднання амінокислоти. Після того, як відбувається приєднання амінокислоти з акцепторною ділянкою тРНК, необхідність знаходження даної ділянки в синтетичному центрі відпадає, тРНК розпрямляється та переміщує приєднану до неї амінокислоту до корекційного центру. При розбіжності розмірів молекули амінокислоти, приєднаної до тРНК, та розмірів корекційного центру, амінокислота упізнається як неправильна та від'єднується від тРНК. Синтетаза готова до наступного циклу. При збігу розмірів молекули амінокислоти, приєднаної до тРНК, та розмірів корекційного центру, заряджена амінокислотою тРНК звільняється: вона готова зіграти роль у трансляції протеїну. А синтетаза готова приєднати нові амінокислоти та тРНК, і почати повторний цикл.
З'єднання невідповідної амінокислоти з синтетазою в середньому відбувається в 1-му випадку з 50 тис., а з помилковою тРНК лише один раз на 100 тисяч приєднань.
- Взаємодія кодону м-РНК та антикодону т-РНК відбувається за принципом комплементарності та антипаралельності
Взаємодія тРНК з кодоном мРНК за принципом комплементраності та антипаралельності означає: оскільки сенс кодону мРНК читається у напрямку 5"->3", то антикодон у тРНК повинен читатися у напрямку 3"->5". При цьому перші дві підстави кодону і антикодону спаровуються строго комплементарно, тобто утворюються лише пари А У і Г Ц. Спарювання ж третіх підстав може відступати від цього принципу. Допустимі пари визначаються схемою:
Зі схеми випливає наступне.
- Молекула тРНК зв'язується лише з 1-м типом кодону, якщо третій нуклеотид у її антикодоні – Ц або А
- тРНК пов'язується з двома типами кодонів, якщо антикодон закінчується на У або Р.
- І, нарешті, тРНК пов'язується з трьома типами кодонів, якщо антикодон закінчується на І (інозиновий нуклеотид); така ситуація, зокрема, в аланіновій тРНК.
Звідси, у свою чергу, випливає, що для впізнавання 61 смислового кодону потрібна, в принципі, не така сама, а менша кількість різних тРНК.
Рибосомальна РНК

Рибосомальні РНК є основою для формування субодиниць рибосом. Рибосоми забезпечують просторове взаєморозташування мРНК та тРНК у процесі синтезу білка.
Кожна рибосома складається з великої та малої субодиниць. Субодиниці включають велику кількість білків і рибосомальні РНК, які не піддаються трансляції. Рибосоми, як і рибосомальні РНК, розрізняються за коефіцієнтом седиментації (осадження), що вимірюється в одиницях Сведберга (S). Цей коефіцієнт залежить від швидкості осадження субодиниць при центрифугуванні в насиченому водному середовищі.
Кожна рибосома еукаріотів має коефіцієнт седиментації, рівний 80S, і її прийнято позначати як 80S-частинку. Вона включає
- малу субодиницю (40S), що містить рибосомальну РНК з коефіцієнтом седиментації 18S рРНК та 30 молекул різних білків,
- велику субодиницю (60S), яка включає 3 різні молекули рРНК (одну довгу та дві короткі - 5S, 5,8S та 28S), а також 45 білкових молекул.
Субодиниці утворюють "скелет" рибосоми, кожен з яких оточений своїми білками. Коефіцієнт седиментації повної рибосоми не збігається із сумою коефіцієнтів двох її субодиниць, що пов'язано з просторовою конфігурацією молекули.
Пристрій рибосом прокаріотів та еукаріотів приблизно однаковий. Відрізняються вони лише молекулярною масою. Бактеріальна рибосома має коефіцієнт седиментації 70S і позначається як 70S-частка, що вказує на меншу швидкість осадження; містить
- малу (30S) субодиницю - 16S рРНК + білки
- велику субодиницю (50S) - 23S рРНК + 5S рРНК + білки великої субчастинки (мал.)
У рРНК серед азотистих основ вище ніж зазвичай вміст гуаніну та цитозину. Трапляються також мінорні нуклеозиди, але не так часто, як у тРНК: приблизно 1%. Це, в основному, нуклеозиди, метильовані по рибоз. У вторинній структурі рРНК багато дволанцюгових ділянок та петель (мал.). Така будова молекул РНК, що утворюються у двох послідовно проходять процесах - транскрипції ДНК і дозріванні (процессингу) РНК.
Транскрипція рРНК з ДНК та процесинг рРНК
ПрерРНК утворюється в ядерці, де знаходяться транскриптони рРНК. Траснкрипція рРНК із ДНК відбувається за допомогою двох додаткових РНК-полімераз. РНК-полімераза I транскрибує 5S, 5,8S і 28S у вигляді одного довгого 45S-транскрипта, який потім поділяється на необхідні частини. Таким чином, забезпечується рівну кількість молекул. В організмі людини в кожному гаплоїдному геном присутні близько 250 копій послідовності ДНК, що кодує 45S-транскрипт. Вони розташовані в п'яти кластерних тандемних повторах (тобто попарно один за одним) в коротких плечах хромосом 13, 14, 15, 21 і 22. Дані ділянки відомі як ядерцеві організатори, так як їх транскрипція і подальший процесинг 45S-транскрипт Ядра.
Не менш ніж у трьох кластерах хромосоми 1 існує 2000 копій 5S-pPHK гена. Їх транскрипція протікає у присутності РНК-полімерази III зовні ядерця.
У процесі процесингу залишається трохи більше половини пре-рРНК і звільняються зрілі рРНК. Частина нуклеотидів рРНК піддається модифікації, що полягає у метилюванні основ. Реакція здійснюється метилтрансферазами. У ролі донора метальних груп виступає S-аденозілметіонін. Зрілі рРНК з'єднуються в ядрі з білками рибосом, що надходять сюди з цитоплазми, і утворюють малу та велику субчастинки рибосом. Зрілі рРНК транспортуються з ядра до цитоплазми в комплексі з білком, який додатково захищає їх від руйнування та сприяє перенесенню.
Центри рибосом
Рибосоми суттєво відрізняються від інших органел клітини. У цитоплазмі вони зустрічаються у двох станах: у непрацюючому, коли велика та мала субодиниці відокремлені одна від одної, і в активному – під час виконання своєї функції – синтезу протеїну, коли субодиниці з'єднуються одна з одною.
Процес з'єднання субодиниць рибосом або складання активної рибосоми позначається як ініціація трансляції. Ця збірка відбувається строго впорядкованим чином, що забезпечується багатофункціональними центрами рибосом. Всі ці центри знаходяться на поверхнях, що контактують, обох субодиниць рибосоми. До них відносяться:
- Центр зв'язування мРНК (М-центр). Він утворений ділянкою 18S рРНК, яка комплементована протягом 5-9 нуклеотидів 5"-нетрансльованого фрагменту мРНК
- Пептидильний центр (П-центр). На початку процесу трансляції з ним зв'язується ініціююча аа-тРНК. У еукаріотів ініціювальний кодон всіх мРНК завжди кодує метіонін, тому ініціюючою аа-тРНК є одна з двох метіонінових аа-тРНК, що відзначається нижнім індексом i: Мет-тРНК i Met . На наступних стадіях трансляції в П-центрі знаходиться пептидил-тРНК, що містить вже синтезовану частину пептидного ланцюга.
Іноді говорять також про Е-центр (від "exit" - вихід), куди переміщається тРНК, що втратила зв'язок з пептидилом, перед тим як залишити рибосому. Однак можна розглядати цей центр як складову П-центру.
- Амінокислотний центр (А-центр) – місце зв'язування чергової аа-тРНК.
- Пептидилтрансферазный центр (ПТФ центр) - він каталізує перенесення пептидила зі складу пептидил-тРНК на чергову аа-тРНК, що надійшла в А центр. При цьому утворюється ще один пептидний зв'язок і пептиди подовжується на одну амінокислоту.
Як в амінокислотному центрі, так і в пептидильному центрі антикодонова петля відповідної тРНК (аа-тРНК або пептидил-тРНК), очевидно, звернена до М-центру - центру зв'язування матричної РНК (взаємодіючи з мРНК), а акцепторна ПТФ центру.
Розподіл центрів між субодиницями
Розподіл центрів між субодиницями рибосоми відбувається так:
- Мала субодиниця.Оскільки саме вона містить 18S-рРНК, з ділянкою якої зв'язується мРНК, то центр знаходиться на даній субодиниці. Крім того, тут знаходяться основна частина А-центру і невелика частина П-центру.
- Велика субодиниця. На її контактуючій поверхні розташовані інші частини П-і A-центрів. У разі П-центру – це його основна частина, а у разі А-центру – ділянка зв'язування акцепторної петлі аа-тРНК з амінокислотним радикалом (аміноацилом); решта ж і більшість аа-тРНК пов'язується з мінімальною субодиницею. Великій субодиниці належить також ПТФ центр.
Ініціація рибосоми (підготовка рибосоми до синтезу білка)
Синтез білка, або власне трансляцію, прийнято розділяти на три фази: ініціації (початок), елонгації (подовження поліпептидного ланцюга) та термінації (закінчення). У фазу ініціації відбувається підготовка рибосоми до роботи: поєднання її субодиниць. У бактеріальних та еукаріотичних рибосом з'єднання субодиниць та початок трансляції протікає по-різному.
Початок трансляції – найповільніший процес. У ньому крім субодиниць рибосоми, мРНК та тРНК беруть участь ГТФ та три білкові фактори ініціації (IF-1, IF-2 та IF-3), які не є складовими компонентами рибосоми. Фактори ініціації полегшують зв'язування мРНК із малою субодиницею та ГТФ. ГТФ за рахунок гідролізу забезпечує енергією процес змикання субодиниць рибосоми.

- Ініціація починається з того, що мала субодиниця (40S) пов'язується з фактором ініціації IF-3, внаслідок цього виникає перешкода до передчасного зв'язування великої субодиниці та можливість приєднання до неї мРНК.
- Далі до комплексу "мала субодиниця (40S) + IF-3" приєднується мРНК (своєю 5"-нетрансльованої ділянкою).
- Далі до комплексу "мала субодиниця + IF-3 + мРНК" приєднуються ще два фактори ініціації: IF-1 та IF-2, при цьому останній несе з собою особливу транспортну РНК, яку називають ініціюючою аа-тРНК. До складу комплексу входить також ГТФ.
Мала субодиниця з'єднуючись з мРНК представляє для зчитування два кодони. На першому їх протеїн IF-2 закріплює ініціаторну аа-тРНК. Другий кодон закриває протеїн IF-1, який блокує його і не дозволяє приєднатися до наступної тРНК до моменту повного складання рибосоми.
- Після зв'язування ініціюючої аа-тРНК, тобто Мет-тРНК i Met за рахунок комплементарної взаємодії з мРНК (ініціювальний кодон АУГ) та встановлення її на своє місце у П-центрі відбувається зв'язування субодиниць рибосоми. ГТФ гідролізується до ГДФ і неорганічного фосфату, а енергія, що виділяється при розриві даної макроергічної зв'язку створює термодинамічний стимул для протікання процесу в потрібному напрямку. Одночасно фактори ініціації залишають рибосому.
Таким чином, формується своєрідний "бутерброд" із чотирьох основних компонентів. При цьому в П-центрі зібраної рибосоми виявляються ініціюючий кодон мРНК (АУГ) і пов'язана з ним аа-тРНК, що ініціює. Остання при утворенні першого пептидного зв'язку грає роль пептидил-тРНК.

Транскрипти РНК, синтезовані за допомогою РНК-полімерази, зазвичай зазнають подальших ферментативних перетворень, звані посттранскрипційним процесингом, і тільки після цього вони набувають своєї функціональної активності. Транскрипти незрілої матричної РНК звуться гетерогенної ядерної РНК (гяРНК). Вони складаються з суміші дуже довгих молекул РНК, що містять інтрони та екзони. Дозрівання (процесинг) гяРНК у еукаріотів включає кілька стадій, в одну з яких відбувається видалення інтронів - нетрансльованих вставних послідовностей та зшивання екзонів. Процес протікає таким чином, що наступні один за одним екзони, тобто кодуючі фрагменти мРНК ніколи фізично не роз'єднуються. Екзони дуже точно з'єднуються між собою за допомогою молекул, які називаються малими ядерними РНК (мяРНК). Функція цих коротких ядерних РНК, що складаються приблизно з 100 нуклеотидів, довго залишалася незрозумілою. Її вдалося встановити після того, як було виявлено, що їхня нуклеотидна послідовність комплементарна послідовностям на кінцях кожного з інтронів. В результаті спарювання основ, що містяться в мяРНК і на кінцях згорнутого в петлю інтрона, послідовності двох екзонів зближуються таким чином, що стає можливим видалення інтрону, що розділяє їх, і ферментативне з'єднання (сплайсинг) кодуючих фрагментів (екзонів). Таким чином, молекули мяРНК грають роль тимчасових матриць, що утримують близько один від одного кінці двох екзонів для того, щоб сплайсинг відбувся у правильному місці (рис.).
Перетворення гяРНК на іРНК шляхом видалення інтронів проходить у ядерному комплексі РНК-білків, званому сплайсомою. Кожна сплайсома має ядро, що складається з трьох малих (низкомолекулярних) ядерних рибонуклеопротеїнів, або снурпів. Кожен снурп містить хоча б одну малу ядерну РНК та кілька білків. Існує кілька сотень різних малих ядерних РНК, що транскрибуються в основному РНК-полімеразою II. Вважають, що їхня основна функція - розпізнавання специфічних рибонуклеїнових послідовностей за допомогою спарювання основ за типом РНК-РНК. Для процесингу гяРНК найважливіші Ul, U2, U4/U6 і U5.
Мітохондріальна РНК
Мітохондріальна ДНК являє собою безперервну петлю і кодує 13 поліпептидів, 22 тРНК та 2 рРНК (16S та 23S). Більшість генів знаходяться на одному (важкому) ланцюгу, проте деяка їхня кількість розташована і на комплементарному їй легкому. При цьому обидва ланцюги транскрибуються у вигляді безперервних транскриптів за допомогою мітохондріоспецифічної РНК-полімерази. Цей фермент кодується ядерним геном. Довгі молекули РНК потім розщеплюються на 37 окремих видів, а мРНК, рРНК та тРНК спільно транслюють 13 мРНК. Велика кількість додаткових білків, які надходять до мітохондрії з цитоплазми, транслюються з ядерних генів. У пацієнтів із системним червоним вовчаком виявляють антитіла до снурп-білків власного організму. Крім того, вважають, що певний набір генів малої ядерної РНК хромосоми 15q відіграє важливу роль у патогенезі синдрому Прадера-Віллі (спадкове поєднання олігофренії, низького зростання, ожиріння, гіпотонії м'язів).
У цитоплазмі клітин містяться три основні функціональні види РНК:
- матричні РНК (мРНК), що виконують функції матриць синтезу білка;
- рибосомні РНК (рРНК), що виконують роль структурних компонентів рибосом;
- транспортні РНК (тРНК), що у трансляції (перекладі) інформації мРНК в послідовність амінокислот молекули білка.
У ядрі клітин виявляють ядерну РНК, що становить від 4 до 10% від сумарної клітинної РНК. Основна маса ядерної РНК представлена високомолекулярними попередниками рибосомних та транспортних РНК. Попередники високомолекулярних рРНК (28 S, 18 S і 5 S РНК) переважно локалізуються в ядерці.
РНК є основним генетичним матеріалому деяких вірусів тварин та рослин (геномні РНК). Для більшості РНК вірусів характерна зворотна транскрипція їхньої РНК геному, що спрямовується зворотною транскриптазою.
Всі рибонуклеїнові кислоти є полімери рибонуклеотидів,з'єднаних, як у молекулі ДНК, 3",5"-фосфорнодіефірними зв'язками. На відміну від ДНК, що має дволанцюжкову структуру, РНК є одноланцюгові лінійні полімерні молекули.
Будова мРНК. мРНК - найбільш гетерогенний щодо розмірів та стабільності клас РНК. Зміст мРНК у клітинах становить 2-6% від загальної кількості РНК. мРНК складаються з ділянок - цистронів, що визначають послідовність амінокислот в білках, що кодуються ними.
Будова тРНК . Транспортні РНК виконують функції посередників (адаптерів) під час трансляції мРНК. Їх частку припадає приблизно 15% сумарної клітинної РНК. Кожній із 20 протеїногенних амінокислот відповідає своя тРНК. Для деяких амінокислот, що кодуються двома та більше кодонами, існують кілька тРНК. тРНК є порівняно невеликі одноланцюгові молекули, що складаються з 70-93 нуклеотидів. Їхня молекулярна маса становить (2,4-3,1) .104 кДа.
Вторинна структура тРНКформується за рахунок утворення максимальної кількості водневих зв'язків між внутрішньомолекулярними комплементарними парами азотистих основ. Внаслідок утворення цих зв'язків полінуклеотидний ланцюг тРНК закручується з утворенням спіралізованих гілок, що закінчуються петлями з неспарених нуклеотидів. Просторове зображення вторинних структур усіх тРНК має форму. конюшинного листа.
У «конюшинному листі» розрізняють чотири обов'язкові гілки, більш довгі тРНК, крім того, містять коротку п'яту (додаткову) гілку. Адапторну функцію тРНК забезпечують акцепторна гілка, до 3"-кінця якої приєднується ефірним зв'язком амінокислотний залишок, і протистоїть акцепторної гілки антикодонова гілка, на вершині якої знаходиться петля, що містить антикодон. кодує відповідну амінокислоту.
Т-гілка, що несе петлю псевдоурідіна (ТyС-петлю), забезпечує взаємодію тРНК з рибосомами.
Д-гілка, що несе дегідроуридинову петлю, забезпечує взаємодію тРНК з відповідною аміноацил-тРНК-синтетазою.
Вторинна структура тРНК
Функції п'ятої додаткової гілки поки що мало досліджені, найімовірніше вона зрівнює довжину різних молекул тРНК.
Третинна структура тРНКдуже компактна і утворюється шляхом зближення окремих гілок конюшинного листа за рахунок додаткових водневих зв'язків з утворенням L-подібної структури «ліктьового згину». При цьому акцепторне плече, що зв'язує амінокислоту, є розташованим на одному кінці молекули, а антикодон - на іншому.

Третинна структура тРНК (за А.С. Спіріном)
Будова рРНК та рибосом . Рибосомні РНК формують основу, з якою зв'язуються специфічні білки під час утворення рибосом. Рибосоми- Це нуклеопротеїнові органели, що забезпечують синтез білка на мРНК. Число рибосом у клітці дуже велике: від 104 у прокаріотів до 106 у еукаріотів. Локалізуються рибосоми головним чином у цитоплазмі, у еукаріотів, крім того, у ядерці, у матриксі мітохондрій та стромі хлоропластів. Рибосоми складаються з двох субчастинок: великої та малої. За розмірами та молекулярною масою всі вивчені рибосоми ділять на 3 групи - 70S рибосоми прокаріотів (S-коефіцієнт седиментації), що складаються з малої 30S та великої 50S субчастинок; 80S рибосоми еукаріотів, що складаються з 40S малої та 60S великої субчастинок.
Мала субчастка 80S рибосом утворена однією молекулою рРНК (18S) та 33 молекулами різних білків. Велика субчасткаутворена трьома молекулами рРНК (5S, 5,8S та 28S) та приблизно 50 білками.
Вторинна структура рРНКутворюється за рахунок коротких двоспіральних ділянок молекули – шпильок (близько 2/3 рРНК), 1/3 – представлена одноважними ділянками, багатими на пуринові нуклеотиди.
Підручник. Незважаючи на те, що тРНК значно дрібніша, розповідь про її будову, особливості та функціонування заслуговує на окремий розділ.
Отже, тРНК є «адаптером», який одним своїм кінцем розпізнає трилітерну послідовність генетичного коду, зіставляючи їй єдину відповідну амінокислоту, закріплену на іншому кінці тРНК. На торкається до матричної РНК кінці транспортної РНК знаходяться 3 нуклеотиди, що утворюють антикодон. Тільки у разі комплементарності антикодону до ділянки мРНК транспортна РНК може приєднатися до неї. Але навіть у цьому випадку тРНК не може приєднатися до мРНК самостійно, їй необхідна допомога рибосоми, яка є місцем їхньої взаємодії, а також активним учасником трансляції. Наприклад, саме рибосома створює зв'язок між принесеними тРНК амінокислотами, формуючи протеїновий ланцюжок.
Особливості будови тРНК обумовлені генетичним кодом, тобто правил побудови протеїну за геном, які транспортна РНК прочитує. Цей код працює в кожному з істот, що живуть на Землі: створення вірусу записано тими ж трилітерними кодонами, які використовуються для запису «інструкції зі складання» дельфіна. Експериментально перевірено, що гени однієї живої істоти, поміщені в клітину іншої, відмінно копіюються і транслюються в протеїни, які не відрізняються від генів, що відтворюються в клітинах господаря. На одноманітності генетичного коду засновано виробництво колоніями модифікованих кишкових паличок інсуліну та багатьох інших людських ферментів, що використовуються як ліки для людей, чий організм не здатний їх виробляти або виробляє недостатньо. Незважаючи на очевидну різницю між людиною та кишковою паличкою, протеїни людини легко створюються за його кресленнями за допомогою копіювального апарату кишкової палички. Не дивно, що транспортні РНК різних істот відрізняються дуже мало.

Кожен кодон із цього списку, за винятком трьох стоп-кодонів, що дають сигнал про завершення трансляції, має розпізнаватись транспортною РНК. Впізнання здійснюється за допомогою приєднання до матричної РНК антикодону, який може зв'язатися тільки з одним кодоном зі списку, тому тРНК може розпізнати лише один кодон. Отже, у клітині існує щонайменше 61 вид цих молекул. Насправді їх навіть більше, тому що в деяких ситуаціях для зчитування матричної РНК недостатньо просто мати потрібний антикодон: потрібне виконання інших умов, відповідно до яких створюється спеціальна модифікована тРНК.
На перший погляд, така різноманітність тРНК має суттєво ускладнювати процес трансляції: адже кожна з цих молекул перевірятиме підставлений їй рибосомою кодон матричної РНК на відповідність своєму антикодону — здавалося б, стільки безглуздої механічної роботи, стільки марно витраченого часу та енергії. Але в результаті еволюції сформувалися також і клітинні механізми, що запобігають цій проблемі. Наприклад, кількість тРНК кожного виду в клітині відповідає тому, як часто амінокислота, несучи цим видом, зустрічається в протеїнах, що будуються. Є амінокислоти, які рідко використовуються клітиною, а часто використовуються, і якби кількість несучих їх тРНК була однаковою, це значно ускладнило б складання протеїнів. Тому «рідкісних» амінокислот і відповідних їм тРНК у клітині мало, а ті, що часто зустрічаються, виробляються у великій кількості.

При такому розмаїтті молекул тРНК всі вони дуже схожі, тому розглядаючи їх будову та функції, в основному ми вивчатимемо загальні для всіх видів риси. Якщо глянути на тривимірну схему тРНК, вона здається щільним нагромадженням атомів. Здається неймовірним, що ця складнозакручена молекула отримана в результаті згортання довгого ланцюга нуклеотидів, але саме так і утворюється.
Можна простежити етапи її утворення, починаючи з найпершого: складання РНК-полімеразою послідовності нуклеотидів відповідно до гена, що містить інформацію про дану транспортну РНК. Порядок слідування один за одним цих нуклеотидів та їх кількість називається первинною структурою тРНК. Виходить, що первинна структура тРНК закодована в гені, прочитуваному РНК-полімеразою. Взагалі первинної структурою називають послідовність порівняно простих молекул одного типу, у тому числі складена складніша, згорнута молекула-полімер. Наприклад, первинною структурою молекули протеїну є проста послідовність складових її амінокислот.

Будь-який ланцюжок нуклеотидів не може перебувати в клітці у розгорнутому стані, просто витягнувшись у лінію. На краях нуклеотидів знаходиться дуже багато позитивно і негативно заряджених частин, які просто утворюють водневі зв'язки один з одним. Про те, як такі ж зв'язки утворюються між нуклеотидами двох молекул ДНК, з'єднуючи їх у подвійну спіраль, розказано в , а за подробицями про водневі зв'язки можна залізти в . Водневі зв'язки менш міцні, ніж зв'язки між атомами в молекулах, але їх достатньо для того, щоб химерно скрутити тРНК і тримати її в такому положенні. Спочатку ці зв'язки утворюються лише між деякими нуклеотидами, згортаючи тРНК у фігуру на зразок листа конюшини. Результат цього початкового згортання називають вторинною структурою тРНК. На схемі зліва видно, що деякі нуклеотиди зв'язуються водневими зв'язками, інші залишаються неспареними, утворюючи кільця і петлі. Відмінності між вторинною структурою різних видів тРНК обумовлені відмінностями у їх первинній структурі. Виявляється це в різній довжині «конюшинних листів» або «стеблинка» за рахунок різної довжини вихідного ланцюжка нуклеотидів.
Іншою відмінністю первинної структури різних тРНК і те, що у деяких позиціях вони стоять одні й самі нуклеотиди (на схемі вгорі вони відзначені першими літерами своїх назв), більшість нуклеотидів у різних тРНК відрізняються друг від друга. Наведена вище схема є загальною для всіх тРНК, тому нуклеотиди, що відрізняються, відзначені числами.
Головними функціональними частинами тРНК є:
=) антикодон, тобто послідовність нуклеотидів, комплементарна єдиному кодону матричної РНК, що знаходиться на антикодонової шпильки
=) акцепторний кінець, До якого може бути приєднана амінокислота. Він знаходиться з протилежного боку від антикодонової шпильки.
Насправді, жодна тРНК не виглядає так, як на схемі вторинної структури, тому що для її утворення з'єдналися між собою лише деякі нуклеотиди, а решта залишилися неспареними. За рахунок утворення водневих зв'язків між нуклеотидами з різних частин листа конюшини він згортається далі в набагато складнішу. третинну структуруу формі літери L. Ти можеш зрозуміти, як саме зігнулися різні частини вторинної структури для утворення третинної, зіставивши кольори на їх схемах нижче. Антикодонова шпилька, позначена блакитним і сірим кольорами, залишається внизу (варто пам'ятати, що це «внизу» є умовним: зручно зображати тРНК саме в такій просторовій орієнтації у схемах трансляції білка), а акцепторний кінець (жовтого кольору) загнутий убік.

Саме так виглядає тРНК, яка готова до приєднання амінокислоти. Самостійно з'єднатися з амінокислотою тРНК не здатна, для цього потрібна участь спеціального ферменту: аміноацил-тРНК-синтетази. Число видів синтетаз у клітині збігається з числом видів тРНК.
Одноманітність форми всіх видів тРНК необхідна для того, щоб рибосома могла розпізнавати будь-яку з них, сприяти їх стиковці з мРНК, переміщувати в собі з одного сайту в інший. Якби різні види тРНК суттєво відрізнялися один від одного, це надзвичайно ускладнило б роботу рибосоми, критично зменшивши швидкість синтезу протеїну. Природний відбір в такий спосіб спрямовано те, щоб зробити тРНК схожими друг на друга. Але водночас є й інший фактор, що вимагає існування помітних відмінностей між різними видами тРНК: адже необхідно розпізнати кожен вид і прикріпити до нього єдину амінокислоту, що відповідає йому. Очевидно, що ці відмінності мають бути хоч і помітними, але не надто суттєвими, тому робота з розпізнавання видів тРНК перетворюється на ювелірний процес. І саме його здійснюють аміноацил-тРНК-синтетази: кожна з них може зв'язатися лише з однією з 20 амінокислот та приєднати її саме до тих видів тРНК, які цій амінокислоті відповідають. З таблиці з генетичним кодом видно, що кожна амінокислота кодується декількома послідовностями нуклеотидів, тому, наприклад, всі чотири тРНК з антикодонами CGA, CGG, CGU і CGC будуть розпізнаватись однією і тією ж синтетазою, що приєднує до них аланін. Такі оброблювані однією синтетазою тРНК називаються спорідненими.
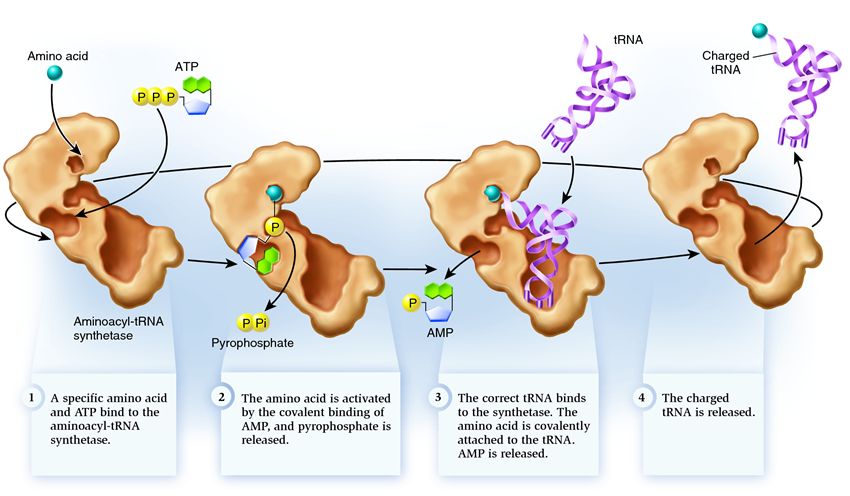
Синтетаза належить до групи ферментів, чия функція полягає у зв'язуванні з окремими молекулами та об'єднанні їх в одну:
1 . синтетаза поєднує амінокислоту та молекулу АТФ. Від АТФ відриваються дві фосфатні групи, вивільняючи енергію, необхідну наступних дій. Аденозинмонофосфат (АМФ), що залишається від зруйнованої молекули, приєднується до амінокислоти, підготувавши її до з'єднання з акцепторною шпилькою.
2 . синтетаза приєднує себе одну з відповідних цієї амінокислоті споріднених тРНК.

На цьому етапі відбувається перевірка відповідності транспортної РНК-синтетазі. Існує кілька способів розпізнавання, і в кожній синтетазі є їх унікальна комбінація. У взаємодії синтетази та тРНК бере участь як мінімум один нуклеотид антикодону. Також вимагає перевірки акцепторна шпилька: визначається наявність на ній специфічних нуклеотидів, загальних для відповідних потрібної амінокислоті споріднених тРНК. Нуклеотиди інших частин тРНК також можуть брати участь у перевірці відповідності, поєднуючись із певними місцями синтетази. Неправильна тРНК може збігатися з потрібною за якимись параметрами, але через неповний збіг приєднуватиметься до синтетази повільно і нещільно, легко відвалюючись. А правильна тРНК прилипне до синтетази швидко та міцно, внаслідок чого структура синтетази змінюється, запускаючи процес аміноацилювання , тобто приєднання амінокислоти до тРНК

3 . аміноацилювання полягає у заміні приєднаної до амінокислоти молекули АМФ на молекулу тРНК. Після цієї заміни АМФ залишає синтетазу, а тРНК затримується для останньої перевірки амінокислоти. Якщо приєднана амінокислота розпізнається як неправильна, вона буде від'єднана від тРНК, місце амінокислоти в синтетазі спорожніє і туди зможе приєднатися інша молекула. Нова амінокислота пройде стадії з'єднання з АТФ і тРНК, і теж піддасться перевірці. Якщо ж помилок не було допущено, заряджена амінокислотою тРНК звільняється: вона готова зіграти свою роль у трансляції протеїну. А синтетаза готова приєднати нові амінокислоти та тРНК, і цикл почнеться заново.
Від правильності роботи аміноацил-тРНК-синтетази залежить багато що: якщо на цьому етапі відбудеться збій, то до тРНК буде приєднана неправильна амінокислота. І вона буде вбудована в протеїн, що росте на рибосомі, адже тРНК і рибосома не мають функції перевірки відповідності кодону і амінокислоти. Наслідки помилки можуть бути незначними або катастрофічними, і в ході природного відбору істоти з ферментами, які не мають функції таких перевірок, були витіснені більш пристосованими, що мають різні варіанти встановлення відповідності між амінокислотою та тРНК. Тому в сучасних клітинах синтетаза з'єднується з невірною амінокислотою в середньому в одному випадку з 50 тисяч, а з помилковою тРНК лише один раз на 100 тисяч приєднань.

Деякі амінокислоти відрізняються один від одного лише кількома атомами. Якщо поглянути на їх схеми, стає очевидним, що можливість переплутати аргінін з аланіном набагато менше, ніж прийняти ізолейцин за лейцин або валін. Тому кожна синтетаза, що зв'язується з однією з схожих один на одного амінокислот, має додаткові механізми перевірки. Ось приклад такого пристосування у ізолейцин-тРНК-синтетази:

Кожна синтетаза існує синтетичний центр, В якому відбувається приєднання амінокислоти до тРНК Акцепторна шпилька тРНК, захопленої синтетазою, потрапляє саме туди, як і амінокислота, готова вступити у реакцію із нею. Робота деяких синтетаз закінчується відразу після з'єднання амінокислоти та тРНК. Але Ile-тРНК-синтетаза має підвищену ймовірність помилок через існування інших схожих на ізолейцин амінокислот. Тому вона має ще й корекційний центр: з назви зрозуміло, яку роль він грає у процесі з'єднання тРНК та амінокислоти. На малюнку справа видно, що положення кінця шпильки акцепторної тРНК в синтетичному центрі Ile-тРНК-синтетази надає цій шпильці неприродний вигин. Тим не менш, синтетаза утримує тРНК у такому положенні до моменту приєднання до неї амінокислоти. Після того, як це з'єднання сталося, необхідність знаходження акцепторної шпильки в синтетичному центрі вичерпана, і тРНК розпрямляється, потрапляючи своїм кінцем з насадженою на нього амінокислотою корекційний центр.

Звичайно ж, синтетичний центр теж грає свою роль у відсіюванні амінокислот, що не підходять синтетазі. Щоб потрапити до нього, молекулі необхідно відповідати ряду умов, зокрема мати відповідний розмір. Незважаючи на те, що лейцин і ізолейцин містять одну й ту саму кількість атомів, через відмінності в просторовій структурі лейцин більший. Тому він не може проникнути в синтетичний центр, розміри якого відповідають компактнішому ізолейцину, і просто відскакує від Ile-тРНК-синтетази.
Але ось валін, що є найдрібнішою з цих трьох молекул зі схожою атомною структурою, легко займає місце ізолейцину в синтетичному центрі, і синтетаза приєднує його до тРНК. Саме в цьому випадку входить у гру корекційний центр синтетази. Якщо акцепторна шпилька, що розпрямляється, заряджена правильно і несе ізолейцин, то вона не може протиснутися всередину корекційного центру: він просто занадто малий для цієї молекули. Таким чином, тРНК, що розпрямилася, більше ніщо не тримає, і вона від'єднується від синтетази. А от якщо до тРНК приєднаний валін, він прослизає в корекційний центр, тим самим утримуючи сполучену з ним тРНК у синтетазі. Таке надмірно тривале перебування тРНК усередині є для синтетази сигналом помилки, змінюючи її просторову конфігурацію. В результаті цього:
=) валін від'єднується від тРНК і видаляється із синтетази
=) акцепторна шпилька повертається до синтетичного центру, очікуючи приєднання до амінокислоти
=) синтетаза пов'язується з новою амінокислотою, «заряджає» їй тРНК і знову перевіряє, чи був використаний саме цього изолейцин.
Такий механізм подвійного розпізнавання вживається й іншими синтетазами.







